Chapter 8 随着蠕虫的蠕动
徐思群正手持蠕虫挑针,灵巧地将微小的线虫从培养皿转移到玻璃载玻片上的一层黏稠琼脂垫。若你在 1997 年 6 月站在他身后观察,可能会怀疑是否有东西被挑起和转移——这些线虫通体透明,比人类睫毛还细,仅一毫米长,即使锐利的眼睛也难以察觉。当 10 条线虫在载玻片上排列整齐后,徐思群透过显微镜目镜观察,将一根超薄玻璃针刺入首条线虫表皮的性腺,注入微量溶解 RNA。他依次为每条线虫完成注射。这操作比穿针引线困难得多,但在成为巴尔的摩卡内基研究所安迪·法尔【 Andy Fire】实验室的科研人员多年前,徐思群曾在中国故乡担任针灸师——这段经历意外地为当天的任务提供了绝佳训练。
通过这些 RNA 注射,SiQun 和 Andy 希望能解决一个困扰蠕虫生物学家的难题。自 1984 年以来,反义 RNA——我们在脊髓性肌萎缩症治疗中遇到的——一直是操纵基因表达的流行工具。其理念是通过引入与 mRNA 互补(“反义”)的 RNA 来阻断蛋白质的产生。反义链会与目标 mRNA 碱基配对,覆盖密码子并阻止蛋白质合成。精确关闭基因的能力可能是理解不同基因功能甚至灭活有害或突变基因的强大工具。
但当反义 RNA 被应用于一种流行的实验生物——秀丽隐杆线虫(Caenorhabditis elegans)时,并未产生预期效果。多位研究线虫的生物学家一直在探索反义 RNA 的作用,其中就包括安迪·法尔(Andy Fire),他们注意到了一些奇怪的现象。作为实验对照,线虫研究人员注入了正义 RNA 而非反义 RNA——即目标 mRNA 序列某部分的完全拷贝。由于 C 碱基不与 C 配对,A 碱基不与 A 配对,以此类推,正义 RNA 本应无法与 mRNA 发生碱基配对。他们完全预期注入正义 RNA 不会产生任何效果。但最令人惊讶的是,他们发现正义 RNA 同样会干扰基因表达。正义链和反义链产生相同的结果,这完全不合常理。
安迪想出了一个可能的谜题解决方案。他曾在麻省理工学院的菲尔·夏普实验室接受培训,因此对 RNA 有所了解。他也知道制备纯正义或纯反义 RNA 具有挑战性,因为实验室中用于将 DNA 转录成 RNA 的酶有时会出错:在生成目标 RNA 的过程中,它们也会产生一些互补链。有没有可能所有人的正义和反义 RNA 制剂之所以有活性,是因为其中含有一些双链 RNA?
安迪承认这是一个“有些牵强的假设”。毕竟,双链 RNA 已经自我配对——这是否意味着这些链无法与其他任何物质配对,从而无法干扰 mRNA 的功能?但线虫成本低廉,而且思群和安迪是注射线虫的专家,所以他们决定试一试。他们将非常小心地纯化正义和反义 RNA 以避免任何交叉污染,然后给一些线虫注射正义 RNA,一些注射反义 RNA,还有一些注射等量混合的正义和反义 RNA 以形成双链 RNA。
他们决定瞄准一个基因,该基因活性的丧失会显而易见。这个名为 unc 的基因(uncoordinated 的缩写)对蠕虫神经系统的正常发育至关重要。unc 基因的突变或失活会导致蠕虫无法控制地抽搐。SiQun 和 Andy 将观察被注射蠕虫的后代,它们的大脑要么正常发育,要么发育异常。方便的是,无需诱导这些蠕虫交配,因为它们是雌雄同体,既能产生精子也能产生卵子,并在体内自我受精。
在注射 RNA 一天后,蠕虫产下了卵,并且卵成功孵化。当 SiQun 和 Andy 轮流通过显微镜观察时,他们看到了令人兴奋且出乎意料的现象。首先,只有双链 RNA 导致所有被注射蠕虫的幼体疯狂抽搐。单独的反义 RNA 链或正义 RNA 链几乎没有效果1; 只有双链组合才具有活性,这表明早期关于单独正义或反义链能破坏蠕虫基因表达的发现,可能确实是双链RNA污染的结果。他们不仅发现双链 RNA 能以某种方式抑制基因表达(至少在蠕虫中如此),还发现其作用异常精准。似乎只有目标 unc 基因受到了双链 RNA 处理的影响。
科学家们还需要几年时间才能解开这些谜团。但就在那时,当安迪·法尔凝视着那些蠕动的蠕虫时,他也在凝视着一项诺贝尔奖。他的工作,连同他在伍斯特马萨诸塞大学癌症中心的合作者克雷格·梅洛的研究,将开创一个全新的分子生物学子领域——RNA 干扰(RNAi)。
科学家们很快揭示,RNA 干扰(RNAi)是自然界中的一种关键调控机制,它能让生物体在信使 RNA(mRNA)转录后降低其活性。这一系统从蠕虫到人类的动物体内都活跃存在,但在安迪·法尔和克雷格·梅洛的双链 RNA 实验捕捉到其信号之前,它一直未被发现。RNAi 再次惊人地证明了 RNA 在生命中的核心地位。此外,由于 RNA 在每种疾病中都携带着遗传信息,正如它在每个健康生命过程中所做的那样,敲低特定 mRNA 的能力具有药物开发潜力——因此 RNAi 很快被转向医疗用途。这个故事既展示了 RNA 治疗的巨大前景,也揭示了伴随其应用的一些挑战。而这一切都始于不起眼的蠕虫。
寂静之声
为什么选择线虫?对大多数人来说,这似乎是个不太可能的实验生物选择,甚至可能像个玩笑。但对悉尼·布伦纳【Sydney Brenner】而言并非如此。20 世纪 60 年代,在帮助破解 mRNA 的秘密后,悉尼将注意力转向了生物学领域最重大的未解挑战之一——理解神经系统。神经系统由大脑、脊髓以及从脊髓延伸出的外周神经元(包括控制肌肉的运动神经元)组成。它主导着动物的运动、记忆、决策和行为。
为了揭开这些谜团,布伦纳必须选择一个实验生物。他之前最喜欢的生物大肠杆菌没有大脑,因此不在考虑之列。布伦纳最终选择了秀丽隐杆线虫(C. elegans),它具有诸多优势。它是拥有大脑的最简单生物之一。成年线虫全身仅有约 1000 个细胞,其中约 300 个是神经元——这些细胞为神经系统提供动力。此外,这些线虫是透明的,因此不同类型的细胞及其连接在显微镜下很容易观察。最后,这些蠕虫体型微小——需要排成 25 条才能达到 1 英寸长——而且它们的世代时间仅为 3 天半,因此饲养成本低廉且易于培育。
布伦纳是如此富有魅力、聪慧过人,且拥有迷人而合群的个性,以至于当时一些最具才华和冒险精神的年轻科学家追随他进入了蠕虫研究的世界。安迪·法尔和克雷格·梅洛便是这些追随者中的两位。安迪在 20 世纪 80 年代中期作为博士后,在英格兰剑桥跟随悉尼研究蠕虫,之后回到美国并在卡内基研究所建立了自己的实验室。克雷格则是在 1982 年由悉尼的另一位学员、我的同事大卫·赫希,在科罗拉多大学博尔德分校引领进入蠕虫研究领域的。
得益于他们在蠕虫实验中的工作,法尔和梅洛实验室的研究人员发现双链 RNA 具有强大的干扰基因表达的能力。但最初这一过程如何运作尚不明确(双链 RNA 如何可能识别单链 RNA 目标?),也不清楚自然界中是否存在类似的过程。
世界各地的实验室随后进行的实验很快解答了第一个问题。科学家们发现了一组此前未被检测到(或至少未被充分重视)的蛋白质,这些蛋白质能让双链 RNA 沉默基因表达。其中一种酶被恰当地命名为 Dicer,它能将长双链 RNA 切割成称为小干扰 RNA(siRNAs)的较小片段。随后,这些片段被另一种酶结合并引导至其作用位点,研究人员以 1708 年一艘拥有 50 门舰炮的法国战舰的名字命名该酶为 Argonaute。
这个称号似乎很贴切,因为 Argonaute 蛋白携带着强大的“武器库”,像军舰一样四处游弋寻找目标。对蛋白质而言,其导航系统是一段 RNA 链。它的靶标是一段信使 RNA,其序列与 siRNA 的一条链(称为“引导链”)互补。当 siRNA 装载进 Argonaute 后,另一条“乘客链”会被排出——留下单链的引导链自由地与目标 mRNA 上的互补序列配对。随后“武器”开始发挥作用:Argonaute 蛋白是一种酶,能够切割并因此使通过碱基配对固定在 siRNA 一条链上的目标 mRNA 失活。这就像 siRNA 是导弹制导系统,将 Argonaute 弹头引导至攻击位置。
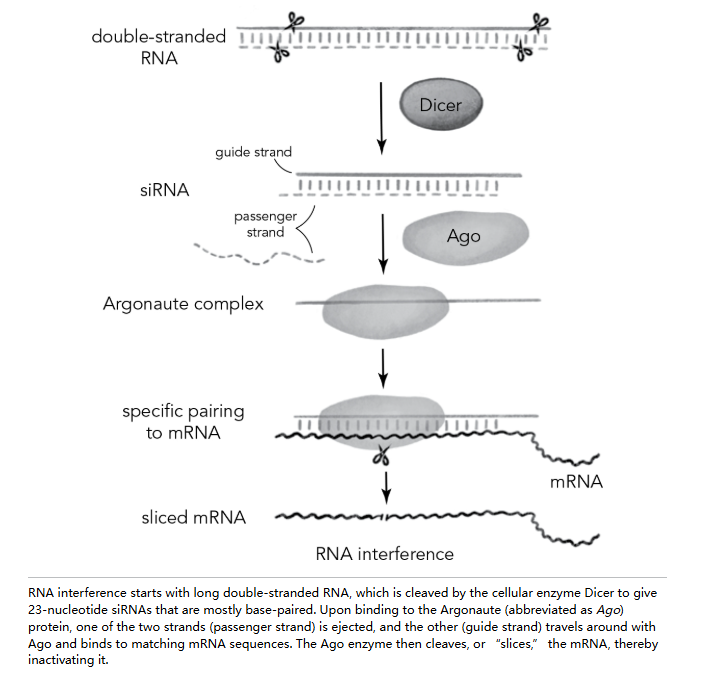
想必 Dicer 和 Argonaute 不会在蠕虫体内无所事事,只等着研究人员来注射双链 RNA。RNA 干扰必定有其正常的生物学功能。但究竟是什么功能呢?事实证明,答案早已被发现,只是需要将各种线索联系起来。从 1993 年开始,哈佛大学的发育生物学家维克多·安布罗斯和马萨诸塞州总医院的遗传学家加里·鲁夫昆就发现了一种极其微小的线虫 RNA,称为 microRNA。这些天然 microRNA 在从胚胎发育为完整生物体的过程中,通过在关键阶段关闭各种蛋白质的合成,发挥着重要作用。这些 microRNA 最初是以较大的 RNA 形式合成的,其内部碱基配对形成长双链片段,类似于 tRNA 三叶草结构中各臂的折叠方式。随后,它们被 Dicer 加工并装载到 Argonaute 上,以抑制天然 mRNA 的活性。这就解释了为什么蠕虫体内预先配备了利用人工注射 siRNA 所需的机制。
大自然费尽心思进化出制造复杂蛋白质的系统,那么为何还需要 microRNA 和 RNA 干扰来推翻所有这些努力?当生物体从胚胎发育为成体时,它必须构建不同的器官,如大脑、肠道、皮肤和生殖器官。要踏上这些不同的发育轨迹,仅制造新型蛋白质是不够的。细胞还需要停止制造旧型蛋白质。这正是 microRNA 为自然工具箱增添的功能:调控特定 mRNA 翻译的能力。
每个 microRNA 不仅会寻找并抑制一个 mRNA,还会抑制一组相关的 mRNAs。其结果是一个极其复杂而精细的调控网络。与其说是抑制基因活性,不如想象一下调控纽约市东河上的交通流量。包括著名的布鲁克林大桥在内的多座桥梁承载着进出曼哈顿的交通;这些桥梁类似于多个基因,在胚胎细胞转变为脑细胞之前,这些基因的活性需要降低。每座桥梁的交通都可能受到曼哈顿发生的事件的影响——道路维修、交通事故或突如其来的暴风雪。这些事件类似于 microRNA 对基因活性的作用。每座桥梁受这些事件影响的程度不同,取决于其位置和其他因素。这些影响是叠加的;一辆抛锚的卡车加上突如其来的暴风雪会真正让交通陷入瘫痪。同样,在 RNA 干扰中,正是 microRNA 结合位点的数量以及这些特定 microRNA 的普遍程度共同作用,调节 mRNA 翻译成蛋白质的过程。
所有这些研究或许都令人着迷且具有开创性,但直到 20 世纪 90 年代末,其应用研究仍主要局限于蠕虫。要想利用 siRNA 关闭基因的医学潜力,首先需要验证这种神奇效果是否适用于更复杂的生物体,尤其是人类。
虫虫之外
汤姆·图施尔【Tom Tuschl】正是那个关键时刻需要的人才——一位才华横溢、全心投入的科学家,致力于将 RNA 干扰的治疗前景转化为拯救生命的现实。我们相识于 1989 年,当时他作为巴伐利亚雷根斯堡大学的交换生在我的实验室工作。他给我的印象是勤奋、聪慧,但我未曾料到他的后续发现竟会如此重要。到 1999 年时,他已在麻省理工学院菲尔·夏普的实验室研究 RNA 干扰现象。他们团队首次证明 siRNA 并非通过某种微妙作用,而是直接切割靶标 mRNA 来实现抑制效果。
汤姆随后返回德国,并迅速取得了一系列关键发现,为利用 RNA 干扰技术制造药物奠定了基础。一个主要问题涉及人类体内是否存在微小 RNA。如果它们存在,那么利用这些 RNA 的机制——包括 Argonaute“剪切”蛋白——也必然存在。倘若如此,或许可以通过引入一种靶向某种疾病相关 mRNA 的双链 RNA,来操控这一机制,从而开发出一种强大的新型药物。
然而,科学家们首先需要确认微小 RNA 的作用不仅限于蠕虫。为此,汤姆从多种物种中纯化了所有 RNA,然后像 Art Zaug 在我们实验室研究四膜虫核酶时那样,通过凝胶电泳按大小分离 RNA。他用剃刀切下凝胶中可能含有非常小的 RNA(约 21 至 23 个碱基对)的部分,留下较大的核糖体 RNA、信使 RNA 和转运 RNA。最终,他从果蝇、鱼类、小鼠以及最重要的人类细胞中发现了数十种先前被忽视的微小 RNA。现在看来,自然界在广泛的生物学领域利用 RNA 干扰来下调基因表达。
鉴于这些微 RNA 都是由基因组编码的,而人类基因组序列的初步公布早在 2000 年就已实现,为何这些微 RNA 却一直未被发现?日常生活中,你会在路灯下寻找丢失的车钥匙,因为那里光线最亮,科学探索也大抵如此。当时绝大多数科研精力都投入到了编码蛋白质的基因研究上,尽管这类蛋白质编码序列仅占人类基因组的 2%。环绕这些蛋白质编码"岛屿"的,是一片名副其实的其他 DNA 海洋。因此,那些微 RNA 基因的微小斑点很容易被忽视。
随着时间的推移,人类体内发现了多达 500 种不同的 microRNA。研究表明,它们参与多种关键生理过程,包括四肢的正常发育、心肌的形成、血细胞(尤其是免疫细胞)的正常生成,以及胎盘发育和妊娠。当 microRNA 功能紊乱时,会引发多种疾病。例如,肿瘤细胞通常会设法降低 microRNA 水平,从而上调促进其生长的基因。以某一种 microRNA 为例,它通常负责抑制促进细胞分裂的基因。而癌细胞会减少这种 microRNA 的产生,从而导致细胞异常增殖。
如果 RNA 干扰的变化能引发疾病,我们是否也能利用它来治疗疾病呢?
猎户座腰带中的指引之星
同年,汤姆·图施尔在发现人类微小 RNA 的同时,还揭示了一个关键现象:仅需一段长约 21 个碱基对的小型双链 RNA,就能有效抑制基因表达。这意味着,科学家们无需像自安迪·法尔和克雷格·梅洛的研究成果公布以来一直所做的那样,用长达数百个碱基对的双链 RNA 处理细胞,再依赖 Dicer 酶将其切割至合适大小。相反,直接提供短双链 RNA 即可实现目标。尤为重要的是,由于汤姆曾在哥廷根接受核酸化学先驱弗里茨·埃克斯坦【Fritz Eckstein】的指导,他掌握了化学合成这些 RNA 的技术。而若小干扰 RNA(siRNA)能通过化学合成获得,它们便具备了成为药物的潜质。汤姆为将 RNA 转化为靶向有害基因 mRNA 的治疗剂奠定了科学基础。
2002 年,汤姆·图施尔【Tom Tuschl】、菲尔·夏普【Phil Sharp】以及夏普实验室的前同事戴夫·巴特尔【 Dave Bartel】和菲尔·扎莫尔【Phil Zamore】共同创立了 Alnylam Pharmaceuticals。Alnylam(或称 Alnilam)是猎户座腰带中的一颗明亮恒星,正如北极星指引北方方向一样,这颗猎户座的恒星有望将公司引向一个全新的治疗药物领域。
是什么让 siRNA 作为潜在的治疗剂如此具有吸引力?设想一下,任何潜在药物的开发都需要解决一系列问题,包括:它对目标的选择性相对于可能同时受到影响的健康生理过程如何?它的副作用有哪些,这些副作用是否可以耐受?有效的治疗剂量是多少?需要多久服用一次?传统药物是小分子有机化合物,比如我们用于缓解疼痛的阿司匹林或用于降低胆固醇水平的阿托伐他汀(立普妥)。对于这类药物,解答所有关于安全性和有效性的问题是一个漫长且昂贵的研发过程,且每开发一种新分子都必须从头开始。药物在克服所有这些障碍之前失败的可能性很大。理论上,siRNA 可以极大地简化这一过程。当然,首次尝试时它仍面临诸多挑战:稳定 siRNA、找到将其递送至体内相关组织的方法,以及确保其安全有效。 但一旦这些问题在某一应用中得到解决,那么针对新疾病可能只需改变 siRNA 上的 A、U、G 和 C 碱基序列以匹配新的 mRNA。稳定性、递送和安全性问题在很大程度上已经“预先获批”。
Alnylam 选择攻克罕见病这一难题,这些疾病在美国定义为患者人数少于 20 万的病症。它们也被称为“孤儿病”,因为患者群体规模太小,制药公司认为不值得投入数十亿美元进行药物研发和人体临床试验。但总体而言,孤儿病代表着巨大的未满足医疗需求。目前已发现超过 3000 种由单基因突变引起的遗传性疾病,仅在美国就有约 2500 万人受其影响。虽然为 3000 种孤儿病开发 3000 种不同药物可能不切实际,但能否开发一种 siRNA 药物,然后调整其序列以匹配 3000 个靶点?能否为所有这些孤儿提供一个支持性的家园?
Alnylam 团队在将 siRNA 转化为有效药物时面临的第一个挑战,是解决如何将其递送至病变细胞的问题。RNA 本身极不稳定,难以成为理想药物;它极易被人体组织中大量存在的核糖核酸酶降解,这些酶负责分解我们食物中的 RNA 或调控细胞基因表达模式的切换。此外,RNA 无法穿透保护细胞免受外来入侵的膜层。因此 Alnylam 的科学家借鉴了 RNA 病毒常用的策略:将 RNA 包裹在脂质外壳中,这种油脂性外壳能溶解于人体细胞膜,使 RNA 进入细胞内部。这种包装方式还能保护 RNA 免受核糖核酸酶的破坏。
在 Alnylam 首次针对封装 siRNA 的临床试验中,其目标是一种名为遗传性 ATTR 的疾病,即由转甲状腺素蛋白(TTR)介导的淀粉样变性。TTR 蛋白在肝脏中生成,通常作为运输载体发挥作用,帮助维持甲状腺激素、维生素 A 及其他分子的正常水平。但对于疾病而言,有时正常蛋白的行为方式反不如突变蛋白的异常行为重要。TTR 基因的遗传突变会导致 TTR 蛋白错误折叠,以纤维形式积聚在神经和心脏中。我们大多数人从未听说过这种疾病,因为它很罕见:全球仅有约 5 万名患者。但对这 5 万人来说,这无异于一场灾难——他们饱受心脏病和神经系统问题的折磨,常常连行走都困难。通常在确诊后约十年内就会导致死亡。
Alnylam 的 siRNA 药物在肝脏中积累,TTR mRNA 在此生成,随后阻止突变 TTR 蛋白的产生。2018 年,该 siRNA 的临床试验完成,结果令人振奋:接受药物治疗的 ATTR 患者病情稳定,行走能力实际有所改善,而对照组中接受安慰剂治疗的患者则持续恶化。
但在药物研发中,你常常解决了一个问题,另一个问题又冒了出来。就 siRNA 疗法而言,包裹在纳米颗粒中的药物必须每月通过静脉注射(IV)给药一次,患者需要前往医院或输液中心,在手臂上插着针头,让药物以缓慢滴注的方式输注一小时。这种方式昂贵、繁琐,而且常常让患者感到痛苦。为了避免静脉注射,Alnylam 的科学家们通过调整双链 RNA,找到了一种通过皮下注射递送 siRNA 的方法。他们添加了一种“把手”,可以被肝细胞表面的受体抓住。虽然这个技巧是针对肝细胞的,但它使得 siRNA 可以通过手臂上的快速注射(就像疫苗接种一样)给药,而不是通过静脉注射。
正如 Alnylam 的科学家们所希望的那样,他们在开发 ATTR 的 siRNA 疗法方面取得的进展,使得攻克其他疾病变得容易得多。2018 年至 2023 年间,他们又有四种针对肝脏的疗法获得了 FDA 的批准,这些疗法都是针对罕见但极具破坏性的疾病。在花费 16 年时间开发出第一种疗法后,此后他们平均每年推出一种。当然,考虑到还有 3000 种单基因疾病有待研究,前方的道路依然漫长。
日益增长的威胁
Alnylam 已证实 siRNA 疗法治疗罕见遗传病的可行性。但对于那些极为普遍的毁灭性疾病呢?随着医学进步,死于传染病的人越来越少。甚至癌症死亡率也在下降:2001 年至 2020 年间,美国癌症死亡率从每 10 万人每年 197 例降至 144 例,降幅超四分之一。但随着寿命延长,人们更可能患上阿尔茨海默病、帕金森病或肌萎缩侧索硬化症(ALS)等可怕的神经退行性疾病。阿尔茨海默病和帕金森病的死亡率正在快速上升——在癌症死亡率下降的这 20 年间增长逾一倍——ALS 同样呈上升趋势。这些疾病不仅使人衰弱,更摧毁家庭——当至亲变得面目全非时,家人往往深陷愤怒、恐惧与悲痛之中。
RNA 直接参与了所有这些疾病的发生。那么,某些版本的 siRNA 技术是否也能用于对抗神经退行性疾病的上升趋势?例如,以 ALS 为例,这种疾病又被称为卢·格里克氏症,以那位受其折磨的棒球运动员命名。ALS 尤其具有破坏性,因为它会在看似健康的个体中突然发作,并迅速进展,攻击运动神经元。在我更广泛的朋友和同事圈中,我曾两次目睹它发作。这些个体正处于生产力巅峰时期,却逐渐丧失了进食、说话、行走,最终呼吸的能力。其中一例,从最初症状出现到瘫痪和死亡历时五年;另一例则仅一年。
尽管许多肌萎缩侧索硬化症(ALS)病例是散发性的,即无家族病史,但也有部分病例具有家族遗传性。这类家族性病例对生物医学科学家尤为重要,因为它们有助于揭示疾病的遗传病因。ALS 最常见的遗传病因涉及一个专业名称为 C9orf72 的基因。正常情况下,该基因包含特定遗传序列 GGGGCC 的少量重复。但在 ALS 患者中,DNA 复制错误会导致该序列出现异常扩增——基因中相同的 GGGGCC 序列重复次数可达数千次。当这种异常 DNA 被转录为 RNA 时,重复序列仍会保留。科学家们仍在努力解析这种非天然 RNA 引发的所有问题,其中一个主要隐患是缺陷 RNA 会捕获并束缚多种蛋白质(包括名为 hnRNP H 的蛋白),而这些蛋白质是 RNA 正常剪接所必需的。由于大量 RNA 剪接蛋白被束缚在重复序列上,它们难以执行正常功能,导致神经元赖以生存的选择性剪接模式遭到破坏。 最终,神经元死亡,患者的身体失去了将信号从中枢神经系统传递到外周肌肉的能力。
借助 RNA 干扰疗法,科学家有朝一日能否切断导致肌萎缩侧索硬化症(ALS)的致病 RNA,阻止病情发展,甚至从一开始就防止其形成?这无疑仍属于推测性设想。例如,将 siRNA 递送至运动神经元远比递送至肝脏更具挑战性。通过血液循环给药可直达肝脏等器官,但突破血脑屏障——这道由紧密排列的细胞构成的天然防御系统(其进化功能是阻隔毒素等有害物质进入脑组织)——则困难得多。任何 RNA 药物在抵达大脑前都会被该屏障过滤,这意味着必须通过侵入性且成本高昂的替代方案(如脊柱椎管内注射)进行递送。此外,由于切断致病 RNA 并不能恢复正常基因功能,siRNA 疗法可能无法实现治愈效果。但鉴于该技术的科学前景与日益增长的医疗需求,研究者仍未放弃开发针对大脑的 siRNA 治疗方案。 在与 ALS 及其他神经退行性疾病的斗争中,我们需要集结所有可用的火力。
阿尔茨海默痴呆症是另一种可怕的神经退行性疾病,可能通过 siRNA 进行治疗。2021 年,仅美国就有超过 600 万人患有阿尔茨海默病,随着人口老龄化,这一数字每年都在上升。这类患者大脑中会积累两种蛋白质聚集体,称为淀粉样斑块和 tau 蛋白缠结,据信会阻碍神经元的正常功能。第一种情况下,一种名为淀粉样前体蛋白的蛋白质被大脑酶切割,产生名为β-淀粉样蛋白的副产物。这种物质在神经元之间积聚,就像牙菌斑在牙齿间堆积一样。第二种情况下,一种名为 tau 的蛋白质不是在神经元周围,而是在其内部积聚,导致缠结并使受体功能紊乱。与所有人类蛋白质一样,淀粉样前体蛋白和 tau 蛋白各自由指导其合成的 mRNA 编码。因此,一种能切割这两种 mRNA 中的一种或两种、从而减少相应蛋白质数量的 siRNA,似乎具有治疗潜力。
2022 年,Alnylam 宣布与以研发抗新冠抗体疗法闻名的生物技术公司 Regeneron 合作启动新项目,共同对抗阿尔茨海默病。具体而言,双方正在开发靶向淀粉样前体蛋白 mRNA 的小干扰 RNA(siRNA)。他们预期降低该蛋白水平将相应减少β-淀粉样斑块的形成。通过将原先靶向肝脏的 siRNA"手柄"替换为新结构,研究团队已成功在小鼠中枢神经系统中安全有效地沉默了淀粉样前体蛋白的表达。
从证明疗法在小鼠身上有效,到确立对人类有效的治疗方案,这条道路漫长而布满荆棘,但我们仍应怀抱最大希望。毕竟,赌注如此之高:逆转神经退行性疾病如今可以说是人类面临的最具挑战性且尚未满足的医疗需求。
从低等的蠕虫中诞生了治疗性 siRNA。这无疑是个非凡的故事,但幸运的是,它并非个例。生物医学领域最重大的突破几乎都源于旨在理解自然运行规律的基础研究,最初并未考虑任何医学应用。安迪·法尔和克雷格·梅洛希望研究控制微小透明蠕虫行为的基因,他们相信适用于蠕虫的机制同样适用于包括人类在内的其他多细胞生物。为了抑制特定基因产物的生成,他们试图改进研究工具,而反义 RNA 看起来很有前景。但通过富有创造力的实验加上些许机缘巧合,他们发现真正起作用的 RNA 并非单链而是双链结构。这一重大发现为全新研究领域——调控包括人类在内所有复杂生物基因通路的 microRNA——以及全新类别的治疗药物打开了大门。
如今我们已经了解到 RNA 在功能失常时可能造成的一些损害。但并非只有那些由好变坏的 RNA——比如导致或加剧神经退行性疾病的 RNA——才值得警惕。从我们的角度来看,有些 RNA 天生就是有害的。很快我们将认识到,引发大规模流行病的许多病毒完全由 RNA 驱动。然而,尽管 RNA 有其阴暗面,理解其运作机制也启示我们如何以其人之道还治其人之身。
尽管在这些特定实验中反义 RNA 未能阻断基因表达,但它在许多系统中具有活性——例如阿德里安·克雷纳和 Ionis 公司开发的治疗脊髓性肌萎缩症的方法。