Chapter 9 精确寄生,潦草复制
那是 1935 年,生物化学家温德尔·斯坦利【在新Wendell Stanley】泽西州普林斯顿洛克菲勒医学研究所的温室里忙着照料他的土耳其烟草植株。当幼苗长到 3 英寸高时,他取出一块纱布垫,浸入储备的烟草花叶病毒液,然后涂抹在叶片上。这种病毒是烟草业的祸害,因其在受感染叶片上产生的马赛克状斑块而得名。19 世纪末的科学家们发现,某些传染源极其微小,能通过阻挡细菌的过滤器;这些传染源后来被命名为病毒。四十年后,科学家们仍不清楚病毒的构成,更不了解它们如何引发感染。斯坦利正致力于填补这一知识空白。
斯坦利将烟草病毒涂抹在叶片上三周后,感染已全面爆发。他割下植株,冷冻后通过绞肉机压榨——虽非精密科学仪器,却行之有效。待浆状物解冻,他挤压出汁液,其中浓稠地悬浮着他痴迷的研究对象:病毒颗粒。通过电子显微镜,他能清晰观察到这些美丽的小棒状体,比大肠杆菌更短且纤细得多。难怪病毒能穿透阻隔细菌的滤网。
斯坦利提纯的烟草花叶病毒溶液浓度极高,竟使病毒结晶化。正如詹姆斯·萨姆纳脲酶蛋白结晶所示,结晶法是获取纯净物质的公认方法:晶体仅含目标分子,杂质尽除。分析病毒晶体成分时,斯坦利发现其近乎纯蛋白构成——确切而言,晶体 94%为蛋白质,另有 6%顽固存在的 RNA。
斯坦利的发现被认为非同凡响。一种病毒,具备繁殖和变异这类生命特性,却仅由简单的蛋白质化学构成。当斯坦利在 1946 年诺贝尔化学奖颁奖演讲中盛赞蛋白质的力量时,*RNA 仅被归入一条脚注。然而,在随后的几十年里,这条脚注的意义不断放大。尽管斯坦利视 RNA 为无关紧要的细节,如今我们却将其视为理解并抗击自然界诸多最可怕病毒的关键。
白嫖党
病毒的存在不可避免。任何有组织的生物系统——细胞、有机体或群体——都必然会出现利用该系统谋取私利却不创造任何价值的实体,我们称之为寄生体。其必然性在于,成为寄生体远比成为功能完备的生物体简单得多。正是催生生物体的化学原理与环境条件,同样也催生了寄生体。
因为病毒的存在是不可避免的,地球上的病毒数量极其庞大。这个数字达到了 1×10^31,比已知宇宙中恒星的数量还要多出 100 亿倍。幸运的是,这些病毒大多是仅感染细菌的噬菌体。它们的多样性如此丰富,以至于当我们在博尔德分子生物学课程上的本科生从土壤、当地垃圾填埋场或动物园的狮子笼中纯化出自己的噬菌体时,每一种噬菌体都必然是一个前所未见的新实体。
每一种病毒都需要自我复制;每一种病毒都需要一组基因来完成其感染周期。斯坦利和其他科学家需要解答以揭开病毒之谜的问题是:这些遗传信息是如何存储的。信息真的嵌入在蛋白质中吗?斯坦利于 1946 年获得诺贝尔奖,就在两年前,纽约市洛克菲勒研究所的奥斯瓦尔德·艾弗里宣布 DNA 是“转化原理”,构成了导致肺炎的细菌基因。然而,遗传物质可能不在核酸中,而是存在于更复杂的蛋白质分子中的想法仍然存在。在他的诺贝尔演讲中,斯坦利回避了这个问题。他从未对病毒可遗传物质的化学性质下注。是蛋白质吗?蛋白质显然构成了病毒的大部分——这也是他获得诺贝尔奖的主题。还是那相对少量的核酸?
无论如何,斯坦利低估了 RNA——而我们现在已经明白,永远不应低估 RNA。但当他在 1948 年搬到加州大学伯克利分校,并为他的新病毒实验室组建团队时,他聘用了一位会给 RNA 应有重视的人。
海因茨·弗伦克尔-康拉特【Heinz Fraenkel-Conrat】前往伯克利的道路曲折迂回。他出生于古城弗罗茨瓦夫(今属波兰),并于 1933 年在该地获得医学学位。目睹德国纳粹主义的兴起,他明智地选择前往爱丁堡攻读博士学位,随后移民美国。他的生物化学家姐夫卡尔·斯洛塔【Karl Slotta】已从波兰迁至巴西圣保罗,继续研究其发现的激素孕酮——这项发现后来催生了避孕药。弗伦克尔-康拉特赴巴西探访斯洛塔并留居当地;二人最终通过研究南美响尾蛇毒液,首次提纯出神经毒素。1952 年,斯坦利将弗伦克尔-康拉特招至伯克利,加入其新成立的病毒实验室工作。
在伯克利,弗伦克尔-康拉特对烟草花叶病毒(TMV)中微量的 RNA 产生了浓厚兴趣。他基于两位德国科学家 1956 年的发现展开研究,该发现表明将纯化的 TMV RNA 涂抹到烟叶上会导致 TMV 感染。似乎不需要任何蛋白质——只需在叶片上划痕就足以让 RNA 进入。这些结果确实有力地支持了 RNA 作为 TMV 遗传物质的观点——除非或许有无法检测到的微量 TMV 蛋白伴随 RNA 一同进入并引发感染。
为了严格验证病毒 RNA 是烟草花叶病毒(TMV)遗传物质这一观点,弗兰克尔-康拉特从一株仅导致叶片局部小斑而非系统性感染的 TMV 毒株中提纯了 RNA。随后,他将该 RNA 与具有完全活性的 TMV 毒株蛋白质重新组装。当这种重组病毒被划伤接种到植物叶片上时,引发了小斑类型的感染。相反,当他组装含有完全活性毒株 RNA 与小斑毒株蛋白质的混合体时,完全活性毒株的特性占据主导。实验证明,决定感染结果的是 RNA 而非蛋白质,这清晰地表明 RNA 才是病毒的遗传物质。
到底谁需要 DNA?
病毒主要分为两大类。一些病毒,如引发水痘和天花的病毒,其遗传物质以 DNA 编码,与地球上的植物、动物及所有其他生物相同。但许多最危险的病毒却由 RNA 构成基因,完全无需依赖 DNA。这类 RNA 病毒不仅包括导致烟草花叶病等植物疾病的病原体,还涵盖引发人类疾病的诸多类型,例如流感、麻疹、腮腺炎、脊髓灰质炎、寨卡、埃博拉以及新冠肺炎(COVID-19)等,不胜枚举。
尽管这些 RNA 病毒可以脱离 DNA 存在,但反之则不然。DNA 病毒仍需要 RNA。就像更复杂的生物体一样,DNA 病毒会将其 DNA 转录为 mRNA,进而编码病毒蛋白质。这使得 RNA 成为所有病毒的共同基础。
RNA 病毒有多古老?我们已经探讨过,地球上第一个自我复制的系统可能由 RNA 构成,因为 RNA 既能作为信息分子,又能作为复制信息的生物催化剂。这就是生命起源的 RNA 世界假说。我敢打赌,在首个 RNA 自我复制系统启动后大约一天,就有一小段寄生 RNA 搭上了便车,被复制却未给系统增添任何价值。每当地球上出现一种新生物,其病毒不久后便会随之而来。此外,病毒能够通过突变改变宿主范围——例如从动物到人类,这一过程称为人畜共患病——意味着总有一大批潜在的新病毒随时准备登场。
经过数百万年的进化,所有 RNA 病毒都必须克服相同的障碍:如何侵入宿主细胞、如何制造所需蛋白质、如何复制其 RNA 基因组,以及如何将自身包装成具有感染性的后代。每种病毒以不同方式解决了这些问题。以 SARS-CoV-2 为例,该病毒进化出了标志性的刺突蛋白,能像电源插头插入插座般精准对接我们鼻腔和肺部细胞表面的 ACE2 受体。一旦病毒锁定细胞表面,它还需绕过细胞的防御系统。这不成问题——由于病毒被脂质包膜包裹,而细胞也有类似的脂质膜结构,两者可直接融合。这就像一碗鸡肉面汤表面漂浮的油脂斑块,当两块油脂相遇时,它们会融合成更大的油斑。此刻,病毒已成功进入细胞内部,可以肆意妄为了。
成就更好的自己
RNA 病毒如何复制其 RNA 基因组呢?这取决于病毒类型。RNA 病毒主要分为两大类:所谓的正链(+)病毒,如 SARS-CoV-2;以及负链(−)病毒,如流感病毒。正链病毒通过首先生成一条负链来复制,随后利用该负链产生更多具有感染性的正链。想象一下制作花园地精石膏模型的过程:先制作一个与地精形状相反的模具,然后向模具中灌注石膏,就能根据需要复制出任意数量的原始地精模型。正链病毒也是如此:一旦合成出互补的负链,就能反复利用它来制造正链。正链 RNA 病毒的另一个关键特征是,感染细胞的病毒 RNA 同时充当信使 RNA。当这种 mRNA 进入宿主细胞质后,会找到人类核糖体——这些核糖体在不知情的情况下,开始合成病毒传染周期所需的蛋白质,其中包括负责复制病毒 RNA 的病毒 RNA 聚合酶。 它们包括衣壳蛋白和刺突蛋白,这些蛋白包裹新生成的病毒颗粒并使病毒具有传染性。
烟草花叶病毒是这一阳性俱乐部的一员。其他感染人类的(+)链 RNA 病毒包括脊髓灰质炎病毒、登革热病毒、甲型和丙型肝炎病毒,以及引起普通感冒的鼻病毒。风疹,或称德国麻疹,由一种(+)链 RNA 病毒引起,曾是儿童时期的祸害之一,直到麻疹、腮腺炎和风疹(MMR)疫苗接种在很大程度上抑制了它。
相反,所谓的负链(−)病毒进入宿主时并非作为可直接编码的 mRNA,而是其互补链。换言之,它们不是以花园地精的形态入侵,而是携带了地精的模具。这类病毒自带复制酶,一旦进入细胞,该酶便开始工作,将(−)链复制成充当 mRNA 的(+)链。这些病毒 mRNA 再次劫持宿主细胞的核糖体来生产其毒性蛋白。所有流感病毒都属于(−)链病毒,呼吸道合胞病毒(RSV)、狂犬病毒和埃博拉病毒亦是如此。腮腺炎和麻疹病毒也属此列,因此 MMR 疫苗可预防两种(−)链病毒和一种(+)链 RNA 病毒。
病毒 mRNA 编码多少种蛋白质?数量差异很大,但通常不会太多。病毒是终极高效的寄生者,尽可能少做工作,并诱骗宿主承担其大部分感染周期的负担。TMV(烟草花叶病毒)效率惊人:其 RNA 仅含 6,300 个碱基,编码四种蛋白质,其中两种负责 RNA 复制,一种促进病毒在植物体内的细胞间转移,最后一种形成圆柱形外壳(即衣壳),将 RNA 包裹在其中心腔内。脊髓灰质炎病毒和流感病毒的基因组分别编码 10 种和 17 种蛋白质。SARS-CoV-2(新冠病毒)则是个真正的“怪物”(从多个方面而言),其基因组编码 29 种蛋白质。虽然这对病毒来说已经非常庞大,但与真正生物体所需的蛋白质数量相比只是九牛一毛。例如,大肠杆菌编码约 4,000 种蛋白质,而人类则编码约 20,000 种蛋白质。
几处拼写错误
我女儿们经常给我发短信,她们飞快的手指常常引发错误:“听起来不错(原为‘食物’)。谢谢!”几秒后又补发一条“食物=不错”,或者“我三点要把孩子们烤醒(原为‘叫醒’)”后接“*叫醒”。有时短信关键位置会出现多处错字,让我完全摸不着头脑。
病毒 RNA 的复制过程亦是如此。少量错误通常能被容忍,甚至可能带来优势,但错误过多则会导致病毒无法存活。负责复制 RNA 的聚合酶大约每 10,000 个碱基会出现一次错误。这个错误率看似不高——毕竟我们在日常事务中犯错的频率远高于万分之一。但由于病毒基因组的长度约为 10,000 个碱基,这样的错误率意味着每次 RNA 复制时,通常都会在某处出现差错。科学家将这类错误称为碱基替换错误(例如用 A 替代了 G),这往往会导致病毒某个蛋白质中的一个氨基酸发生改变。此类变化可能是中性的;可能削弱病毒的生存能力;偶尔也可能增强病毒的适应性——例如,帮助病毒更紧密地结合靶细胞、更快地复制、抵抗抗病毒药物或逃避免疫抗体。
伊利诺伊大学一位脾气暴躁的科学家索尔·斯皮格尔曼【 Sol Spiegelman】是最早直接展示病毒如何从错误中获益的人之一。在这个有时显得刻板的领域里,他如同一股清流——这位生物化学家难得地在通常枯燥的科研论文中使用“圣经般的”这样的词汇来增添色彩。1961 年,斯皮格尔曼对 RNA 噬菌体进入细菌后如何复制其基因组的问题产生了浓厚兴趣。这种复制对病毒的生存至关重要,但当时科学家对其机制仅有模糊的认识。
为了解答这个问题,斯皮格尔曼需要获取一种噬菌体 RNA 聚合酶,即 RNA 病毒用于自我复制的酶。他发现一种名为 Q-beta 的噬菌体能产生一种性质稳定、易于提纯的聚合酶。Q-beta 是一种(+)链病毒,在试管实验中,斯皮格尔曼观察到其酶如何以病毒携带的 RNA 为模板,制作其互补副本,并利用该互补链大量生成噬菌体 RNA。正链生负链,负链再生正链。
在他最具洞察力的实验中,斯皮格尔曼做出了大胆之举,摒弃了细菌甚至病毒本身。他仅将 Q-beta RNA 与其聚合酶简单混合,观察它在短短一天内在实验室中复制与进化的过程。这些实验帮助我们理解了复制过程中的错误如何催生具有新能力的变异病毒。
斯皮格曼进行的首批进化实验之一探讨了这样一个问题:“如果对 RNA 分子提出的唯一要求是遵循《圣经》的训诫——繁殖,并附加以尽可能快的生物条件,它们会发生什么变化?”为了实现这一点,斯皮格曼进行了一项名为“连续转移”的实验。他设置了一排试管,每支试管中都装有含有 RNA 核苷酸的简单盐溶液,这些核苷酸是新 RNA 复制的构建模块。他在第一支试管中滴入了一滴 Q-beta RNA 和聚合酶。二十分钟后,试管中充满了复制的 RNA。他从中取出一滴,用来“接种”第二支试管。在几轮让复制进行 20 分钟后,他通过将转移间隔时间缩短至 15 分钟、然后 10 分钟、最后 5 分钟来提高难度。通过这种方式,他对系统施加压力,使得每次都是复制速度最快的分子胜出,最终占据整个群体。
经过一天的进化,斯皮格尔曼观察了最终试管中的内容。他最初拥有 3300 个核苷酸的病毒 RNA 已自我削减成一个仅含几百个核苷酸的“小怪物”。他意识到,Q-beta 聚合酶一直在犯错,偶尔会跳过其 RNA 模板的一部分。在快速复制受到奖励的条件下,需要复制的碱基越少越具有选择优势,于是这个小怪物赢得了这场竞赛。
斯皮格尔曼测试了其他选择性压力。当他向复制中的噬菌体 RNA 中加入少量核糖核酸酶时,大部分 RNA 如预期那样被降解并消失——RNA 确实非常讨厌核糖核酸酶。但一个罕见的 RNA 分子,其突变恰好发生在核糖核酸酶偏好切割的位点上,因此得到了一定程度的保护。经过多轮复制后,一种抗核糖核酸酶的突变体出现,并在核糖核酸酶存在的情况下愉快地复制着。
这种噬菌体 RNA 的进化预示了我们最近在 SARS-CoV-2 病毒 RNA 中看到的情况。当 SARS-CoV-2 席卷全球人口时,它发生了无数次变异,其中一些变异被证明赋予了它优势。以 Omicron 变种为例,该变种于 2021 年 11 月首次向世界卫生组织报告,距首批 COVID-19 病例发现已近两年。与病毒的原始武汉株相比,Omicron 在 Spike 蛋白上有 35 个突变,每个突变都导致单个氨基酸变化。这些突变的氨基酸位于 Spike 蛋白与人类细胞外部受体结合的部分,增强了其锁定细胞表面的能力,这可能是 Omicron 比早期变种更具传染性的原因。同时,这些突变使病毒更能抵御针对先前 Spike 蛋白版本产生的抗体,从而降低了治疗性抗体治疗和疫苗接种的效果。
并不是病毒试图逃避抗体,而是其复制酶不断出错,无意中一直在测试新的变种。那些恰好能逃避免疫反应的突变病毒得以存活并繁衍。
请再次包住我
宇航员在太空舱的有限空间内绕地球轨道运行,太空舱的两大主要功能是:保护他们免受外太空危险的侵害,并在任务完成后引导他们返回地球。如同宇航员一样,病毒 RNA 不能以裸露的 RNA 形式移动,而是需要被包裹在衣壳中。衣壳保护 RNA 免受人体组织(如核糖核酸酶)的危害,并引导病毒 RNA 到达其靶细胞。拥有衣壳至关重要,因此病毒 RNA 利用其有限基因组的一部分来编码一种或多种蛋白质,这些蛋白质与 RNA 组装形成衣壳。
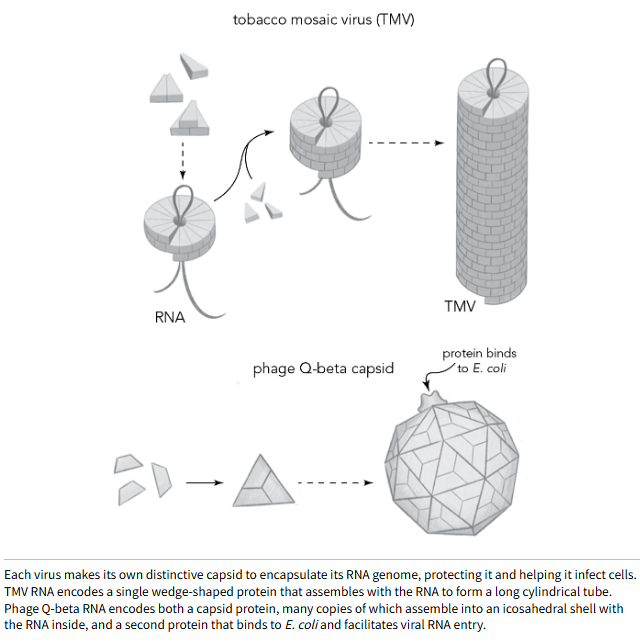
正如索尔·斯皮格尔曼的实验所展示,病毒承受着保持基因组小型化的压力,以便快速复制,因此每个基因都弥足珍贵。其结果是,病毒仅用最少数量的蛋白质构建模块来形成其衣壳。烟草花叶病毒(TMV)仅使用单一类型的蛋白质构建模块,每个蛋白质分子与前一个及下方的分子紧密嵌合。这些蛋白质被设计成以弯曲阵列组装,最终形成一个中心有孔、可容纳 RNA 的圆柱形管状结构。这一构建过程如同用相同的楔形乐高积木砌墙,通过拼接使墙体环绕成管状。
噬菌体 Q-beta 形成了一种形状截然不同的衣壳。古希腊人探索几何学并提出了柏拉图立体——仅由三角形构成的 3D 结构。其中最简单的一种是二十面体,一个由 20 个三角形组成的近乎球形的盒子。但早在古希腊人之前,噬菌体 Q-beta 就已经以近乎完美的二十面体形状组装它的小家了。178 个由单一噬菌体编码的蛋白质自我组装,形成了大部分二十面体,即容纳病毒 RNA 的小盒子。然后,第二个蛋白质的一个副本封闭了这个盒子。这种蛋白质还与大肠杆菌上的毛发状突起结合,帮助病毒识别并进入其细菌猎物。
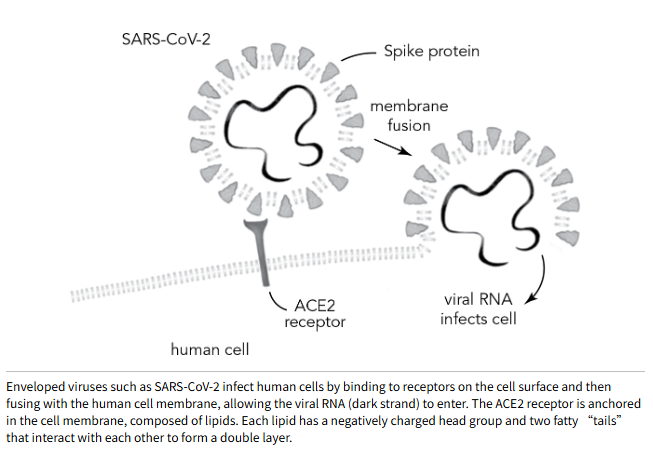
对于某些 RNA 病毒来说,衣壳就像一个“太空舱”,足以保护 RNA 并将其运送到目的地。然而,其他病毒的衣壳外还包裹着另一层结构——由脂质分子构成的包膜。带有包膜的 RNA 病毒包括流感病毒、呼吸道合胞病毒(RSV)以及冠状病毒(如 SARS-CoV-2)。病毒无需自行制造脂质包膜,而是在宿主细胞内组装时直接窃取。用肥皂和水洗手能有效防护包膜病毒,因为肥皂会溶解病毒包膜中的脂质,从而破坏病毒。仅用水冲洗手上的黄油或油脂效果不佳;水会直接流过,油脂仍残留。但肥皂能溶解油脂,同样也能溶解包膜病毒。
当它披上这层新的脂质外衣时,包膜病毒会用自身合成的一种或几种蛋白质装饰这层外衣——例如,SARS-CoV-2 的刺突蛋白,其中 90 个像王冠("corona")上的尖刺一样从冠状病毒表面突出。正是这种刺突蛋白与人类肺、鼻、肠、皮肤或脑细胞表面的特定受体结合,使病毒得以进入。而疫苗产生的抗体所针对的也正是这种刺突蛋白。
成熟的病毒颗粒通过搭便车的方式——即细胞外排——离开细胞,这是细胞为输出自身部分蛋白质而发展出的途径。总体而言,一个进入细胞的 SARS-CoV-2 病毒大约在 8 小时内产生约 600 个子代病毒。如果每个子代病毒继续感染另一个细胞,那么单个病毒在 16 小时内会产生 36 万个病毒,24 小时内则达到 2.16 亿个病毒。难怪我们可能从感觉完全良好到被病毒感染迅速击倒。
我们将病毒视为真正的祸害。它们给我们、家人及朋友带来不便或使我们丧失能力,打乱了我们生活的生产节奏。有时甚至夺走部分人的生命。然而,不得不承认它们效率之高令人叹服。仅凭几十个基因就能让世界天翻地覆,这绝对是非凡的。当然,它们完全依赖于一个毫无察觉的宿主来提供其感染周期所需的大部分资源。它们是彻头彻尾的剥削者。
在它们的成就清单上再添一笔,病毒的适应能力极强。它们在复制 RNA 时产生的错误足够多,以至于几乎每个病毒与其兄弟姐妹都略有不同。因此,当环境发生变化——例如,当它们遭到我们免疫系统中的抗体或抗病毒药物的攻击时——病毒群体中通常会有某个个体恰好具备应对新挑战的解决方案。
只有了解病毒的构成及其运作机制,我们才能有效对抗它们。正如新冠疫情所教导我们的,对抗基于 RNA 的病毒,一种有效方法是使用基于 RNA 的疫苗。凭借人类的智慧,我们得以将 RNA 的巧妙特性转化为对抗其自身的手段。