Chapter 2:生命的剪接(Splice of Life)
很难想象还有比冷泉港实验室更适合举办科学研讨会的田园背景了。这座坐落于长岛湾畔的机构看起来更像是一处夏令营而非研究中心——鱼鳞板小屋、微风中轻摇的帆船,以及春日里因盛放的木兰、杜鹃和山茱萸而熠熠生辉的起伏草坪。自 1890 年创立以来,该实验室始终以严谨(尽管略显保守)的研究著称。从 20 世纪 40 年代起,隐居的遗传学家芭芭拉·麦克林托克【Barbara McClintock 】就是在这里通过追踪玉米粒颜色变化的艰苦实验,揭示了基因和染色体在细胞内的运作机制。她发现的"跳跃基因"最终为她赢得了诺贝尔奖。
冷泉港实验室的沉寂在 1968 年吉姆·沃森【Jim Watson】担任主任后发生了翻天覆地的变化。沃森极具洞察力、雄心勃勃且行事果断,迅速将实验室打造成了一个不断产出重大科学突破的科研重镇。与此同时,该实验室也成为了分子生物学家们分享最新发现的世界知名会议中心。这里过去是、现在依然是科学家们无需等待数月后论文发表,就能第一时间了解前沿动态并建立新合作的圣地。
1977 年 6 月冷泉港研讨会的主题是高等生物染色体的结构与功能。当时我正在麻省理工学院从事该领域的博士后研究,能参加这场研讨会让我激动不已。我至今仍记得那个震撼时刻——当两支研究团队(一支由我在 MIT 的邻居菲尔·夏普【Phil Sharp】领导,另一支由冷泉港的里奇·罗伯茨【Rich Roberts】领导)登上讲台,揭开了困扰科学家们十余年的谜题答案时,全场爆发出电流般兴奋的氛围。
这个重大谜题是什么?一旦 DNA、由此产生的 mRNA 和蛋白质之间的关系在大肠杆菌及其噬菌体中被阐明,许多科学家便转向研究更复杂的生物体,如植物、动物,尤其是人类。他们有充分的理由认为,生物信息存储和传递的基本特征在所有生命形式中都是保守的。正如诺贝尔奖得主雅克·莫诺【Jacques Monod】曾说的:“任何在大肠杆菌中被发现为真的事实,对大象也必然成立。”但当生物化学家研究在培养皿和恒温箱中培养的人类细胞时,他们感到困惑。他们预期 mRNA 会首先出现在细胞核中,因为其染色体 DNA 母体位于那里。确实,他们在那里发现了 RNA,但它似乎太大了,不像是 mRNA——平均比编码一个蛋白质所需的 RNA 大 10 倍。这很奇怪,因为从细胞核输出到细胞质的 mRNA 大小刚好适合制造蛋白质。
这个在细胞核内发现的超大 RNA 真的会转变为 mRNA 吗?如果是的话,那些核 RNA 中不编码蛋白质的多余核苷酸又有什么作用?正如那天在冷泉港所揭示的,答案将首次暗示 RNA 的能力远不止于充当 DNA 的信使。
秘密
虽然我碰巧在麻省理工学院与菲尔·夏普的实验室隔街相望,但这并不意味着我能第一时间见证菲尔的发现。偶尔,我会穿过埃姆斯街去他在癌症中心的实验室,请教实验故障排除的建议。我的朋友克莱尔·摩尔【Claire Moore】在那里工作,她和菲尔总是乐于讨论我的研究——但对他们自己的成果却异常沉默。
这很奇怪。科学家们通常忍不住会滔滔不绝地谈论他们的研究,那个可能就在下一个转角处的激动人心的发现。但菲尔、克莱尔和博士后研究员苏·伯杰特【Sue Berget】知道他们即将取得重大突破,因此决定保持沉默。直到一年后,我坐在冷泉港的礼堂里,才了解到菲尔和里奇·罗伯茨是如何解开人类信使 RNA 尺寸不匹配之谜的。
关键线索最终来自腺病毒——一种导致人类感冒的 DNA 病毒。正如噬菌体为第一批分子生物学家提供了理解细菌遗传活动的途径,人类病毒为研究人类生物学的分子细节打开了一扇门。毕竟,噬菌体和人类病毒都通过欺骗宿主细胞提供其感染周期所需的机制来运作,因此这些寄生虫必然与宿主使用相同的基本生物学机制。研究病毒还具有实际优势:受感染的细胞含有大量病毒 DNA 及相应的 RNA 产物,为研究人员提供了丰富的实验材料。
麻省理工学院和冷泉港实验室的研究团队最初着手绘制腺病毒染色体上各基因的位置分布。他们并未预料这会带来重大发现;基因定位仅为后续研究病毒基因表达机制奠定必要框架。当研究人员将病毒 DNA 与细胞质中发现的 mRNA 拷贝进行比对时,原本预期两者序列会像细菌中那样严格同步地从一端排列到另一端。
相反,他们发现 mRNA 中存在的大段内部序列——如果 mRNA 是 DNA 的直接拷贝,这些序列本应存在——竟然凭空消失了。这些序列似乎被“剪接”了,中间部分被切除,两侧的序列则连接在一起。研究人员不得不承认,腺病毒基因的编码区并非连续不断,而是被我们现在称为内含子的非编码 DNA 片段分割开来。
冷泉港实验室的听众们震惊不已。当天在场的吉姆·沃森本人称这一发现为"重磅炸弹"。信使 RNA 本应是其基因的连续拷贝。如果它是其他任何形式,似乎都极其低效,而且很难理解为什么 DNA 的蛋白质编码区会被内含子分割,或者内含子如何被剪接出去。所有这些复杂的操作——代码片段被混入 DNA 又从 mRNA 中移除——难道只是毫无意义的杂技表演,某种毫无结果的进化舞蹈?还是说这个剪接过程或许服务于某种更宏大的目的?有一段时间,分子生物学界为了回答这些问题而天翻地覆。
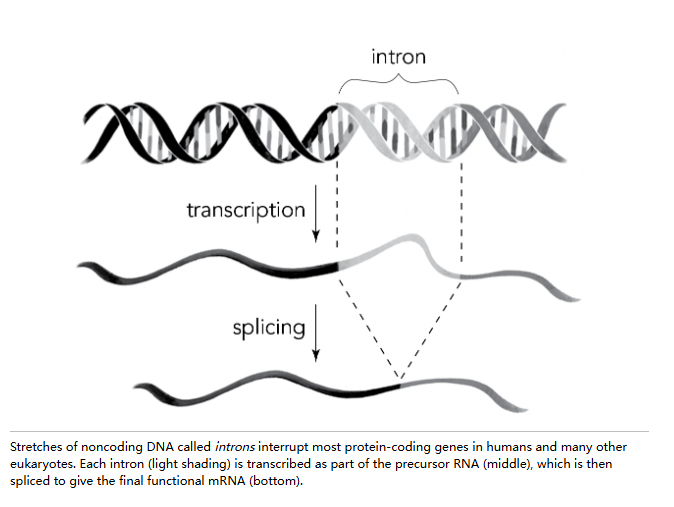
很快,赌注变得更高了。科学家们开始认识到,内含子不仅限于病毒,而是真核生物——即形成细胞核以隔离其 DNA 的生物体——的一个共同特征。一旦腺病毒内含子的存在被宣布,世界各地实验室的许多科学家意识到,他们一直在研究的基因同样被内含子分割。例如,1977 年晚些时候,哈佛生物学家雪莉·蒂尔曼【 Shirley Tilghman】和菲尔·莱德【Phil Leder】发现,编码血液蛋白血红蛋白的人类基因的编码区被两个内含子分割。内含子和编码序列都从基因复制,在细胞核中形成一条长 RNA——但在 mRNA 被输出到核糖体制造蛋白质之前,大自然母亲拿出她的修剪剪刀,神奇地剪掉了这些干扰。
菲尔·夏普使用“剪接”这个词来描述这一过程,以传达类似于水手对严重磨损的绳索段进行的修复工作。水手可能会在磨损段的上方和下方剪断绳索,丢弃损坏的部分,然后将两段完好的绳头重新连接或“接合”起来。
或者,我们可以将内含子想象成几个无意义的词,一串“blah blah”,打断了一个原本可理解的句子:你今天闻起来真香 blah-blah-blah-blah-blah。使用文字处理系统,我们可以迅速修正:只需高亮显示这些冒犯性的打断,按下“删除”键,这些 blah 就被剪接掉了。你今天闻起来真香。自然界使用类似的过程将内含子从 mRNA 中编辑掉,留下一个干净的遗传密码,可以用来制造蛋白质。
现在科学家们明白了为什么最初在细胞核中制造的 RNA——包含所有这些内含子——比剪接掉内含子的 mRNA 要大得多。但正如科学中常见的那样,回答一个问题又引出了另一个问题。这些内含子的功能是什么?它们像一些科学家认为的那样毫无价值吗?或者它们实际上可能是理解大象与大肠杆菌之间差异的关键,甚至是我们之所以为人的关键?
人类基因组令人困惑的大小
基因组是指一个生物体内所有染色体中的全部 DNA。在人类基因组于 2000 年左右被测序之前,我们对于人类需要多少基因才能制造出构成我们自身的所有必需蛋白质一无所知。但这并未阻止我们做出各种猜测,其中大多数结果被证明错得离谱。
这得怪酵母。没错,就是那个让面包面团膨胀、让啤酒和葡萄酒发酵的酵母。酵母是一种单细胞生物,没有大脑、心脏、四肢,也没有胃、肝脏或肠道。它甚至没有生殖组织——酵母细胞通过出芽繁殖,芽体逐渐长大直至脱离母体形成新细胞。因此,相较于由数百种细胞构成的人类,酵母进行生命活动所需的基因数量显然应该少得多。
1996 年,酵母基因组成为首个被测序的真核生物基因组。研究发现,酵母基因组包含约 6000 个蛋白质编码基因。 当时人类基因组计划刚刚启动,人们纷纷下注猜测:人类基因会有多少?肯定比简单的酵母多得多!巡回演讲中的著名科学家们预测人类基因数量将达到 10 万甚至更多。
因此你可以想象,当 2003 年人类基因组序列最终公布时科学家们有多震惊——我们得知人类仅有约 2.4 万个蛋白质编码基因,只比卑微的酵母多出约四倍。这怎么可能?这完全不合常理。人类和酵母都是基于 DNA 的生物体,我们怎么可能在遗传效益上比处于食物链底端的真菌亲戚只高出这么多?
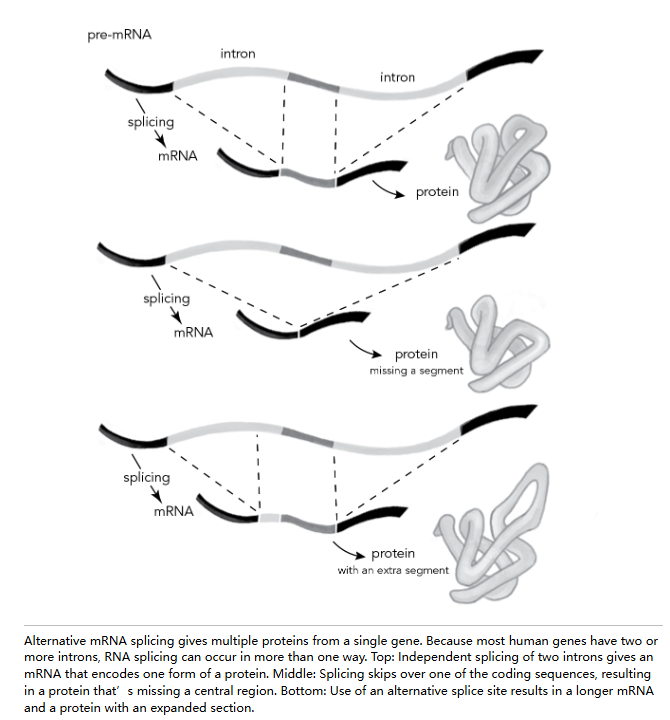
答案的一个重要部分与“无用”的内含子有关。在酵母中,大多数基因没有内含子,而那些有内含子的基因通常只有一个,因此 RNA 剪接只有一种方式。但在人类中,内含子不仅仅不是一种麻烦。它们非常有用。它们为 RNA 提供了灵活的空间,以多种方式剪接代码,从而从同一组基因中产生多种潜在的蛋白质。
这类选择性 mRNA 剪接的首批实例发现于 1980 年,即剪接现象本身被揭示后不久。例如,当剪接机制跳过一段编码序列时就会发生这种情况,如前页图示所示。
让我们回到上面那个包含两个内含子的句子:你今天闻起来真的哔哔香哔哔哔哔哔。通常两个内含子都会被剪除,最终版本是:你今天闻起来真香。但若选择性跳过"香"字,就会将"闻起来"直接连到"今天"。剪接后的句子就变成了"你今天闻起来真今天",虽然保留了原句大部分词汇,却传递出完全不同的含义。
这种选择性剪接——从单一语句衍生多重含义——使得有限的基因组能产生更复杂的蛋白质阵列,从而形成更复杂的生物体。 这至关重要,因为典型的人类基因会产生四到五种不同的剪接 mRNA 及蛋白质产物。正是这一关键特性,让出乎意料小的人类基因组塑造了如今的我们。
我最喜欢的 mRNA 选择性剪接的例子之一发生在我们的免疫系统中。B 细胞是一种白细胞(专业术语称为淋巴细胞),它们通过产生抗体来保护我们免受感染,这些蛋白质能识别并中和侵入体内的外来病原体。在 B 细胞生命周期的早期阶段,抗体会展示在其外表面,随时准备与特定抗体结合的病原体——比如冠状病毒——相遇。随后,B 细胞转换模式,释放出这些抗体,使其在血液中循环流动,再次与病毒上互补的形状结合。在最初形态时,抗体如同站岗的哨兵;而到了第二阶段,它们则化身为追击入侵者的猎手。
两种抗体——表面受体与循环形式——在结合病毒的部位完全相同,但它们的另一端却有所不同。附着在 B 细胞上的那种抗体有一个油腻的末端,能将自己锚定在细胞膜上;而循环版本则有一个糖基化末端,使其从细胞膜释放,得以在血流中自由移动。这两种形式均由同一人类基因编码。从该单一基因复制出的 RNA 可通过两种剪接方式,生成部分相同但截然不同的两种蛋白质:好比“你今天闻起来真不错”与“你今天真有味道”的区别。RNA 选择性剪接实现了这种对单一基因的高效双重利用。
那么大象与大肠杆菌的区别何在?全看你如何剪接它了。
“U” 标记位置
动物制造巨大的前体 mRNA,仅仅是为了剪切和粘贴它们以制造有用的 mRNA,这一发现令人震惊。但科学家们发现了剪接现象,并不意味着他们理解了这一过程是如何运作的。一个主要问题是如何识别内含子以便将其消除。剪接位点必须被极其精确地识别,因为即使是一个碱基的滑动也会产生移码突变,改变所有下游密码子并破坏蛋白质的功能。
与许多做出突破性发现的科学家一样,琼·阿格辛格·施泰茨(Joan Argetsinger Steitz)也借助了偶然的机遇,揭示了自然如何在某个剪接位点"留下标记"。1963 年,琼作为班级中唯一的女性,也是吉姆·沃森(Jim Watson)研究组首位女研究生,进入哈佛大学生物化学博士项目。完成噬菌体 RNA 方向的博士研究后,她与同为生物化学家的丈夫汤姆·施泰茨(Tom Steitz)前往英国剑桥著名的分子生物学实验室工作。在那里,琼与弗朗西斯·克里克(Francis Crick)、悉尼·布伦纳(Sydney Brenner)等顶尖学者合作。然而当施泰茨夫妇转赴加州大学伯克利分校时,校方明确表示汤姆能获得教职,而琼只能以丈夫助理的身份受聘——生物化学系主任直言不讳:"我们所有教授的夫人都喜欢当研究助理。"于是 1970 年,夫妇二人迅速转投耶鲁大学,双双获得助理教授职位。
在耶鲁大学,琼开始对哺乳动物细胞核中产生的大 RNA 分子产生兴趣。那时距离内含子的发现还有几年时间,因此人们还不清楚这些大 RNA 是 mRNA 的前体。琼希望获得能作为工具使用的抗体,用以识别并可能抑制与这些大核 RNA 结合的蛋白质活性。实验过程包括向大鼠注射目标蛋白,使大鼠免疫系统——将人类蛋白质视为外来物质——产生针对该蛋白的抗体,就像对抗病毒入侵者一样。但她试图让大鼠产生此类抗体的过程充满痛苦——字面意义上的痛苦。至今她的一根手指上还留着被大鼠咬伤留下的疤痕。
1979 年,琼听说狼疮患者——一种人体免疫系统攻击自身组织的疾病——体内被发现会产生针对自身细胞核成分的抗体。这些抗体是否可能识别与核内 RNA 结合的蛋白质?她派实验室的医学生迈克尔·勒纳穿过马路去耶鲁大学免疫学部门取这类患者的血清样本,其中含有抗体。
琼和她的学生很快发现,狼疮患者体内正在产生针对自身细胞核内小 RNA 结合蛋白的抗体。这对狼疮患者而言是个坏消息——我们本应制造抗体对抗外来入侵者,而非攻击自身细胞成分——但对科学界却是喜讯,因为这些被称为小核 RNA(简称 snRNA)的分子将成为理解 mRNA 剪接奥秘的关键。此前科学界已知道存在六种富含尿嘧啶(RNA 字母表中的 U)的 snRNA,分别命名为 U1 至 U6。但直到 1979 年,它们的功能仍是个未解之谜。
此时距离冷泉港实验室宣布基因被内含子分裂的爆炸性发现已过去两年,科学家们又陆续发现了更多人类内含子实例。现在,所有人都想知道细胞如何区分哪些序列需要保留以生成信使 RNA,哪些需要剪切除去。这个问题成为包括琼实验室在内的所有 RNA 研究团队持续讨论的热点话题。
琼知道内含子的大小和序列各不相同。但这些内含子的两端看起来几乎完全相同,都以类似于 GUAAGU 的序列开头,并以 AG 结尾。琼敏锐地意识到,RNA 的单链区域天然倾向于通过互补碱基配对与另一个 RNA 的单链区域配对。因此,内含子末端的保守序列有可能通过与某个 U RNA 配对而被识别并标记为剪接位点。于是,琼和迈克尔·勒纳扫描了这些序列,寻找匹配之处,果然发现了:U1 snRNA 一端的序列与已知人类内含子序列的起始部分在纸面上完美契合。这种匹配好得不像巧合,因此他们提出了一个大胆的假设:也许 U1 就是识别每个内含子起始位置的媒介,从而使其能够在该点被精确切割。
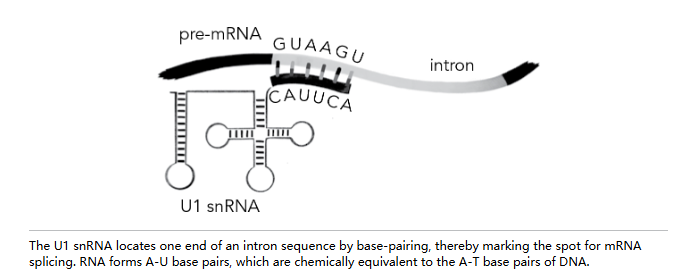
几年之内,这一猜想经受住了多项实验的验证。例如,菲尔·夏普的实验室开发了一种试管系统来观察 mRNA 剪接反应,他们与琼的实验室合作,观察识别 snRNA-蛋白质复合物的抗体是否会抑制剪接。如果 U1 snRNA 确实是识别第一个剪接位点的实体,那么剪接过程应会被抗体抑制。而合作研究确实观察到了这种行为。
那么内含子另一端保守的 AG 序列呢?那里的情况稍显复杂。U2 snRNA 与内含子末端附近的互补序列碱基配对,但识别 AG 剪接位点的是与 U2 snRNA 相关的一种蛋白质。
发现 snRNA 是 mRNA 剪接机制的一部分,为 RNA 的功能增添了新的一笔:它能标记出关键位点,就像在互联网地图上钉下一个图钉。这一功能特别适合单链 RNA,因为它总是准备好进行碱基配对,A 与 U 配对,G 与 C 配对。我们已经两次见证这一点,先是 mRNA 密码子与转运 RNA 中的反密码子配对,现在又看到 snRNA 在 mRNA 剪接位点或其附近进行配对。
然而,尽管内含子的剪接过程展现出令人惊叹的精确性,自然界中并无完美之事。意外时有发生,就内含子而言,剪接错误可能带来灾难性后果。
RNA 剪接出错
通常,如果某个生化过程对人类健康至关重要,那么当该过程出现故障时,就会引发疾病。事实上,1981 年——就在 mRNA 剪接被发现仅四年后——血液疾病β-地中海贫血成为首个被确认由剪接错误导致的疾病。
β-地中海贫血是地中海国家、中东和亚洲最常见的遗传病之一。患者因贫血导致红细胞数量减少,从而引发低氧、疲劳及早逝风险。血红蛋白——红细胞中运输氧气的蛋白质——由四条氨基酸链构成:两条相同的α-珠蛋白链加上两条相同的β-珠蛋白链。β-地中海贫血患者因血红蛋白缺乏β链而贫血,但与另一种影响红细胞的疾病——由β-珠蛋白基因单突变引起的镰刀型细胞贫血不同,有时β-地中海贫血患者的密码子中并未发现可解释病因的突变。
耶鲁大学的 Sherman Weissman 及其同事对一名依赖输血的 12 岁希腊裔塞浦路斯女孩产生了浓厚兴趣,她患有β-地中海贫血症。他们分离并测定了该女孩的β-珠蛋白基因序列,解开了谜团:突变并非发生在 mRNA 的密码子区域,而是位于其基因的内含子中。该突变引入了一段类似剪接位点的 AG 序列,干扰了剪接机制,导致其错误识别 RNA 上的位置。同年晚些时候,伦敦的研究人员直接证实内含子中的突变会导致 mRNA 剪接异常。每当剪接机制使用这个伪装的突变位点时,就会产生无法编码β-珠蛋白的异常 mRNA。
尽管 RNA 剪接有时会导致疾病,如这些β-地中海贫血病例所示,但它也能成为治疗手段。脊髓性肌萎缩症(SMA)最早由医生在 1890 年描述,是一种破坏性的神经退行性疾病,每 11,000 名婴儿中就有 1 人患病,因此相对常见。患有 SMA 的儿童会经历进行性肌无力和运动能力丧失,大多数在两岁前夭折。该疾病具有遗传性,由运动神经元存活基因 1(SMN1)的突变引起。在健康人体内,SMN1 基因编码的蛋白质帮助 snRNA 与其蛋白质伙伴组装。由于这一功能对所有细胞类型都至关重要,为何运动神经元特别容易受到 SMN 蛋白缺失的影响尚不明确,但事实确实如此。
因此,任何想要治愈脊髓性肌萎缩症的科学家面临的问题是如何弥补缺失的 SMN 蛋白。巧合的是,人类基因组中存在许多基因重复的情况,还有第二个运动神经元存活基因 SMN2,它编码与 SMN1 相同的蛋白质。但重要的是,SMN2 具有不同的内含子。当其 mRNA 被剪接时,通常会被跳过制造功能性 SMN 蛋白所需的关键密码子片段,导致产生无功能的 mRNA。但如果可以调整 SMN2 RNA 的剪接,使其能够弥补由 SMN1 突变引起的必需蛋白质的缺失呢?
2002 年,冷泉港实验室的 Adrian Krainer 想到了一种可能挽救 SMN2 剪接以补偿 SMN1 缺失的方法。他发现 SMN2 的 mRNA 中有一个干扰其正常剪接的位点。选择性 mRNA 剪接通常由称为剪接因子的组织特异性蛋白调控,这些蛋白与前体 mRNA 上的特定序列结合,增强或抑制某些剪接位点的使用。这些位点原本是为了健康地调控剪接而进化出来的,但在这个案例中,剪接因子却干扰了正常剪接。Adrian 推断,如果能以某种方式掩盖或隐藏这个干扰序列,或许可以恢复 SMN2 mRNA 的正确剪接。
为了验证这一想法,阿德里安与圣地亚哥一家名为 Ionis 的生物制药公司合作,该公司擅长利用所谓的反义 RNA 片段开发药物。这类 RNA 经过设计,其序列能与特定的天然 RNA 序列互补。例如,若某 mRNA 含有编码甘氨酸的 GGG 密码子,反义 RNA 就会被构建成 CCC 序列。凭借这种互补性,反义 RNA 会通过 G-C 碱基配对与目标 RNA 结合,从而在物理上阻断蛋白质与目标 RNA 的结合。
阿德里安和 Ionis 公司共同设计了一段反义 RNA,它能结合并“隐藏”干扰 SMN2 RNA 正常剪接的序列,同时还包含一些化学修饰,便于其作为药物递送。经过数年的努力,他们将这一概念变为现实,首先在培养细胞中,随后在模拟人类脊髓性肌萎缩症(SMA)致病缺陷的小鼠模型中,成功恢复了功能性 SMN 蛋白的产生。
但真正的考验将是在真实患者身上进行的临床试验。在阿德里安研究该疾病的过程中,他与长岛一个家庭建立了联系,他们的女儿艾玛·拉尔森被诊断出患有中度严重的脊髓性肌萎缩症,其 SMN1 基因部分活跃。艾玛在一岁前发育正常,之后突然开始难以握住奶瓶甚至无法抬头。艾玛的父母决心为这个拥有不屈精神的小女孩竭尽所能,他们立刻抓住机会让她参加了反义 RNA 药物的临床试验。
艾玛的母亲讲述了艾玛接受第二针反义药物(现命名为诺西那生【Nusinersen】)后发生的事。“我当时在卧室,”黛安·拉尔森回忆道,“艾玛在客厅。要知道,她平时移动不超过几英尺。突然,我听到她的声音越来越近。她做了什么?‘艾玛?’我喊道。紧接着,她就出现在卧室门口的地板上,就在我旁边。我简直惊呆了!不敢相信她竟然从客厅一路爬了过来。”
艾玛对诺西那生钠的积极反应在临床试验的其他参与者中也有体现——以至于美国食品药品监督管理局提前一年终止了试验并批准了该疗法。截至 2020 年,全球 40 个国家已有超过 8000 名 SMA 患者接受了诺西那生钠治疗。它虽非根治手段——当治疗起效时,神经元已遭受不可逆的损伤——但确是救命良方。未来的希望在于及早发现携带基因缺陷的新生儿并立即治疗,从而阻止脊髓性肌萎缩症的发展。
Nusinersen 的成功让人们对反义疗法及其通过指导 RNA 剪接发挥积极作用的潜力产生了更广泛的兴趣。例如,杜氏肌营养不良症是一种使人衰弱的遗传性疾病,由于缺乏一种称为肌营养不良蛋白的关键蛋白质而导致肌肉功能逐渐丧失,通过改变 RNA 剪接模式来生成缺失的蛋白质可能会改善病情。相反,许多常见癌症,如胰腺癌、肺癌和结直肠癌,是由致病蛋白驱动的,因此抑制 mRNA 剪接的反义核酸有可能阻止致癌蛋白的产生并遏制癌症发展。正如我们将继续看到的,失控的 RNA 是许多人类疾病的根源。因此,基于 RNA 的疗法——反义与正义配对——为医学的未来带来了巨大希望。
剪接的发现揭示了信使 RNA 并不总是 DNA 双螺旋中所存储信息的直接拷贝。在包括人类在内的高等生物中,最终将成为信使 RNA 的 RNA 最初是从 DNA 中逐字复制而来的,其中包括代码中的大段中断——内含子。但 RNA 剪接随后会切除内含子,将编码序列拼接在一起,并产生离开细胞核与核糖体结合的信使 RNA。乍一看,这个过程似乎极其低效;自然界为何要在基因的编码序列中插入内含子,却又在 RNA 水平上再次将其剪除?但这些复杂的操作有一个重大优势。RNA 剪接可以在不同的位点发生,这一事实为有限的基因组赋予了前所未有的多功能性,并帮助我们成为现在的样子。
探索 mRNA 剪接机制的历程为 RNA 的功能增添了新维度,人们发现小核 RNA 对精确定位剪接位点至关重要。这些 snRNA 与转运 RNA、核糖体 RNA 一同被归入非编码 RNA 家族,在细胞生物学中扮演关键角色。但更重大的发现还在后头:科学家很快意识到,非编码 RNA 不仅能搭建蛋白质合成的框架或标记作用位点,更能主动驱动反应进程。在许多基础细胞活动中,RNA 本身就是催化剂。