Chapter3.孤军奋战(Going it Alone)
是什么让你兴奋不已?答案无一例外是酶。这些物质在所有生物体内驱动着生化反应:它们让心脏跳动,分解胃中的食物,代谢我们饮下的酒精。酶还合成我们体内每个细胞的每一部分——从支撑细胞结构的骨架,到将 DNA 整齐包裹的染色体,再到构成所谓细胞膜的油脂外衣。酶是自然界派对的启动者。
从化学角度讲,酶能加速或催化反应,这听起来平淡无奇——直到你领略到它们惊人的力量。它们能将两种化学物质自然反应的速度提升百亿倍。有酶参与只需一秒的反应,若无酶催化则需 317 年。仅人类体内就有约一万种酶。虽然某些酶为动物界所独有,但许多维持身体运转的所谓“管家酶”却普遍存在于从老虎到毒蘑菇的各类物种中。
早在 19 世纪,科学家们就能在试管中观察到酶作用的结果。德国化学家爱德华·布赫纳证明,酵母细胞中含有一种名为“zymase”的酶,能将含糖溶液转化为酒精和二氧化碳,后者以气泡形式释放。这一过程就是我们熟知的发酵。
早在初期,科学家们就观察到这些酶催化的反应具有极高的特异性;也就是说,酶对它们所作用的物质及生成的产物极为挑剔,这与化学反应更为混杂的情况截然不同。科学家们测量并能够预测酶促反应的速度,例如,当他们添加更多酶或糖时,发酵速度会如何变化。整本书都详细记载了酶的作用。然而,令人惊讶的是,科学界无法确定这些酶究竟由什么组成。这个问题的答案成为了一场漫长而充满争议的科学探索的主题。在某些关键方面,这场探索类似于寻找遗传物质的努力,后者最终导致了 DNA 双螺旋结构的发现。正如奥古斯丁修道士格雷戈尔·孟德尔【Gregor Mendel】知道必定存在某种离散的遗传单位控制着他的豌豆植株的性状,却不知道它由什么构成一样,科学家们也知道有一种强大的物质在催化生化反应,但对于它是什么却无法达成一致。
詹姆斯·萨姆纳【James Sumner】是一位热爱户外运动的人,他在一次狩猎事故中失去一只手臂后投身化学研究。20 世纪 20 年代,他提出酶是蛋白质的理论,从而偏离了科学主流。在康奈尔大学的实验室里,他成功分离并结晶了尿素酶——这种酶能将尿素(存在于尿液中)分解为氨和二氧化碳。众所周知,晶体非常纯净,例如你撒在汉堡上的小立方体食盐晶体就是纯净的氯化钠。因此,当结晶尿素酶显示出纯净蛋白质特性并保持其酶活性时,萨姆纳正确地得出结论:这种酶实际上是一种蛋白质。当时仍有质疑者,但在接下来的三十年里,随着众多其他酶被结晶并同样被发现是蛋白质,科学范式发生了转变。到 1946 年发表诺贝尔奖演讲时,萨姆纳已毫无顾虑地陈述了这个众人公认的事实:"所有的酶都是蛋白质。"
三十年后,当我作为一名研究 RNA 的年轻科学家时,我发现自己面临着一个问题:这条基本法则是否可能从根本上就是错误的。如果真是这样,那么我和其他科学家将不得不以完全不同的视角来看待 RNA——它不仅仅是 DNA 的信使,蛋白质生产中的被动参与者,而是能够驱动生物学的催化剂。
一切始于池塘浮渣
1978 年,在麻省理工学院完成博士后研究后,我以助理教授的身份搬到了博尔德的科罗拉多大学。我被分配到了化学楼三层一个非常陈旧的研究实验室。我的目标是进行前沿科学研究,但我的实验室看起来像是十九世纪的产物,有着磨损严重的黑色皂石实验台和涂了清漆的橡木抽屉。然而,这是我作为独立科学家的第一个实验室,所以对我来说它显得无比辉煌。
当我环顾那个空荡荡的房间时,完全不知道自己将要发现什么。但我清楚自己需要帮手,因此最先做的事之一就是招聘一名研究技术员。大约有 30 名应聘者回应了我在《丹佛邮报》刊登的招聘广告,其中只有一人附有推荐信,上面写着“他有一双金手,经手的每个实验都能成功”。当时 Art Zaug 正在康涅狄格州的卫斯理大学工作,我通过电话对他进行了面试。尽管我无法提供高薪或稳定的工作保障,他还是接受了我的邀请,搬到科罗拉多州,开始与我的新实验对象——一种名为四膜虫的单细胞池塘微生物共事。
当时,我和地球上几乎所有其他生物科学家一样,仍然将 RNA 视为一种中介物,总是扮演 DNA 的配角。我是个研究 DNA 的人——我的博士和博士后研究都围绕着双螺旋结构展开。但我的研究正让我逐渐接近 RNA。当我来到博尔德时,我试图理解 DNA 是如何在被称为转录的过程中被复制成 RNA 的。就像中世纪的僧侣将圣经文本誊写到新的羊皮纸上一样,细胞酶将 DNA 转录成 RNA。
转录的基本原理在细菌中已经得到了充分研究。但正如我向 Art 解释的那样,我试图理解真核生物——那些将 DNA 储存在细胞核内的生物体中的转录机制。大多数关于真核生物的基础研究都采用酵母、果蝇或小鼠作为实验对象,因为我们可以操控它们的基因;或者使用人类细胞和组织,因其具有医学相关性。我对这些选择并不热衷,因为在酵母、果蝇或小鼠中,任何一个特定基因都如同大海捞针。我希望分离出一个完整的基因及其天然蛋白质伙伴,因此我需要一种能给我带来优势的真核生物。
让我们来认识一下嗜热四膜虫(Tetrahymena thermophila),这种遍布全球淡水池塘的单细胞毛球生物。它形如微型西瓜,周身覆盖着纤毛,在显微镜下显得憨态可掬,活像一只没有脸的仓鼠。四膜虫细胞增殖极快,每三小时就分裂一次,这意味着它们需要每三小时将蛋白质含量翻倍。为了建造完成这一壮举的分子工厂——核糖体,每个四膜虫细胞携带了约 1 万份核糖体 RNA 基因副本。试想人类基因通常只有两个副本(分别来自父母),而这个小家伙竟有 1 万份基因副本,你就能理解为何它会吸引我的注意——这好比在干草堆里找针,若草堆里有 1 万根针自然容易得多。更妙的是,四膜虫的核糖体 RNA 基因还有另一神奇特性:出于某种未知原因,它们以独立 DNA 短片段形式存在,而非像其他基因那样紧密排列在巨型染色体上。这一特性使得完整分离核糖体 RNA 基因成为可能,而对于比之大千倍的人类染色体#而言,这几乎是不可能完成的任务。 仿佛四膜虫的 DNA 早已精心包装好,系着丝带与蝴蝶结,只待科学家前来接受这份馈赠。
只是又一次无聊的案例?
我们的目标是理解这些四膜虫基因如何被转录为 RNA,以及结合在 DNA 上的蛋白质——真核生物染色体的一个特殊特征——如何调控这一过程。没过多久,阿尔特那双“黄金之手”就开始发挥作用。他以令人惊叹的精准度完成实验,成为实验室学生们宝贵的资源。很快,大家开始排队使用他配制的盐溶液——他们知道,如果是他配制的,就一定能用;而如果是自己配制的,理论上……也应该能用。当实验室有人准备发表成果时,有时会请阿尔特“最后再做一次”关键实验,因为他们明白,自己的实验数据固然不错,但他的数据将完美无瑕。
我们很快发现,所研究的四膜虫基因含有一个内含子,这个内含子相当小,仅由约 400 个碱基对组成。起初我们认为这不过是又一个“无关紧要的片段”打断基因关键功能区的案例,正如菲尔·夏普和里奇·罗伯茨两年前在信使 RNA 中报道的那样。我们的研究对象是核糖体 RNA(rRNA)而非信使 RNA,但我们推测基本机制是相同的。尽管科学家们对这类内含子如何进入基因尚未达成共识,但我们确信它们必须被移除。每当基因被转录成 RNA 时,内含子都必须被极其精确地剪切掉,才能产生功能性 RNA 分子——无论是编码蛋白质的信使 RNA,还是构成蛋白质合成核糖体一部分的核糖体 RNA。
作为一个 DNA 研究者,我对内含子并不太感兴趣。相反,我致力于理解转录过程。我们要解决的第一个问题很简单:我和阿尔特能否观察到 DNA 正在被复制成 RNA?
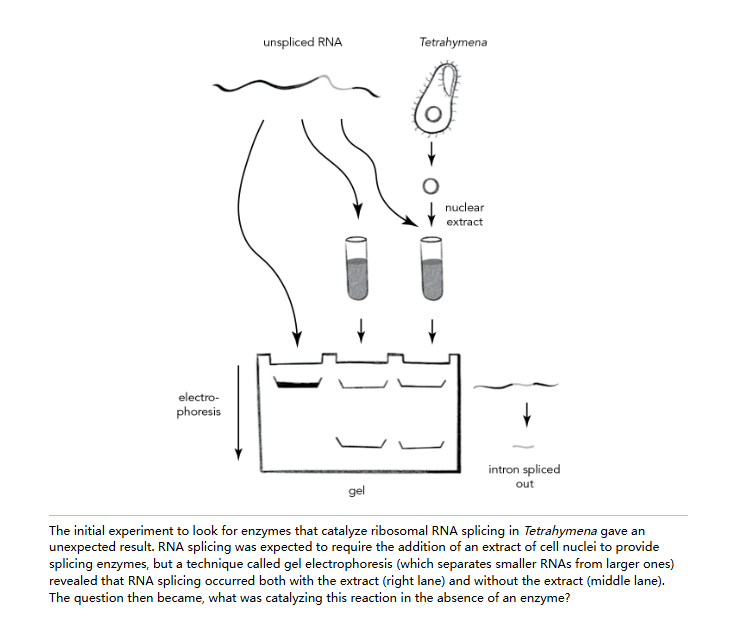
在我们最初的实验中,无需物理分离四膜虫核糖体 RNA 基因;相反,我们使用了一点魔法蘑菇酱。阿尔特纯化了四膜虫细胞核,并加入了一撮来自美丽红伞鹅膏菌的毒素。这种成分当然不适合出现在勃艮第炖牛肉中,但在我们的生化配方里,它具备一种实用特性:能毒害制造 mRNA 和 tRNA 的 RNA 聚合酶,却让制造 rRNA 的酶毫发无损。因此,我们可以确定试管中产生的任何 RNA 都仅源自 rRNA 基因。我们的生化配方还加入了一撮放射性核苷酸,它们会被整合到分离细胞核中合成的任何 RNA 里,从而让我们能在实验中追踪其去向。当所有成分混合后,我们将细胞核静置在试管中一小时,给予 RNA 充分的合成时间。
随后,Art 使用了一种名为凝胶电泳的技术来分析产生的 RNA。凝胶是一种类似果冻的柔软片状材料,当在其两端施加电场时——顶部为负极,底部为正极——带负电的 RNA 分子会被推着穿过凝胶。较小的 RNA 分子比较大的分子能更快地在凝胶中蠕动穿行,因此 RNA 分子会形成离散的条纹或“条带”,显示出它们的大小。
随后,阿尔特会将凝胶带入暗房,在上面铺一张 X 光胶片,让它曝光一整夜,第二天早上再冲洗出来。X 光胶片之所以有效,是因为 RNA 分子已被放射性同位素标记,每条 RNA 带会缓慢地使胶片相邻部分感光。因此,医生用来检查你是否骨折的同款胶片,在我们这里却能呈现凝胶中 RNA 的影像。
阿尔特和我希望能看到核糖体 RNA,果然它在 X 光胶片上显示为一条深色条带。令我们惊讶的是,还出现了一条约 400 个碱基的小得多 RNA。这会是什么呢?又经过几次实验,阿尔特确定了——这是内含子 RNA,不知怎地,在我们试管反应期间从大 rRNA 转录本中脱落了出来。
突然间,我们对内含子的兴趣飙升。当时,科学家们对看似多余的内含子如何从 RNA 中被剪切掉充满了强烈的好奇,而我们似乎意外地捕捉到了这一过程的进行。理解任何生化反应机制的第一步,就是让它在试管中、生物体外发生,这样人们才能控制反应的所有要素。通常需要数年才能实现这样的生化反应,但每次我们合成这种四膜虫 RNA 时,剪接反应都会发生。看来,这段 RNA 给了我们一个前排座位,让我们得以观看剪接表演。
我们原以为这种 RNA 剪接是由蛋白质酶催化的。毕竟,被剪除的内含子长度精确,暗示存在一种精准的酶在起作用,正如萨姆纳所言:"所有的酶都是蛋白质。"因此,我和阿尔特设计了一个实验,试图找到四膜虫的剪接酶——或者说是多种酶,因为可能有两种:一种负责剪除内含子,另一种负责将有用的 rRNA 片段重新拼接起来。我们知道 RNA 剪接发生的位置——四膜虫细胞核内。我们也知道被剪接的对象——新复制的 RNA。于是我们首先设计了一种方法,在 RNA 尚未经历剪接时将其分离出来,使其仍保留内含子。接着,我们在试管中将两种物质混合——未剪接的 RNA 和破碎的四膜虫细胞核。通过凝胶电泳分离 RNA,并用 X 光胶片检测任何 RNA 剪接活性。
第一次尝试这个实验时,我们激动地发现 400 碱基的内含子 RNA 已从更大的 rRNA 中被剪接出来。在科学实验中能如此迅速地重现自然过程实属罕见。事实上,我们的朋友、加州大学圣地亚哥分校的 John Abelson 花了四年艰苦卓绝的努力,才在试管中成功捕获酵母 mRNA 的剪接过程。
但事情有些古怪。像任何熟练的科学家一样,阿尔特设置了一系列对照实验,以确保我们观察到的任何反应都是合理的。在一个良好的对照样本中,生化配方中的某一成分会被省略,而其他条件保持不变。如果这个“实验”是烤蛋糕,对照实验可能包括只省略面粉,或只省略鸡蛋,或只省略巧克力。面包师很快就会发现面粉和鸡蛋是必不可少的成分,而巧克力是可选的,从而强化了他认为自己知道如何烤蛋糕的观点。在阿尔特的 RNA 剪接实验中,省略反应中的四膜虫细胞核是一个很好的对照,因为细胞核被认为是催化剪接反应的酶的来源。我们预计这个没有细胞核的样本不会产生任何结果。然而,令人惊讶的是,RNA 剪接仍然发生了。400 个碱基的内含子在 X 光片上清晰可见,好像它的剪接不需要任何酶的帮助。这不仅奇怪,而且是前所未有的。 翻开当时出版的任何一本高中或大学生物学教材,你都会了解到蛋白质酶是唯一负责催化细胞内反应的物质。然而,令人惊讶的是,这里的过程似乎仅由 RNA 完成。真是这样吗?接下来的一年里,我一直担心可能有一种来自四膜虫的蛋白质酶在纯化过程中以某种方式附着在我们的 RNA 上,而这种酶才是我们在试管中观察到的 RNA 剪接的真正原因。如果我们的 RNA 被蛋白质污染了,我们当然不能到处宣称 RNA 可以催化自身的剪接。也许我们只需要找到一种方法甩掉这个假想中的蛋白质,然后我们的 RNA 就会停止自我剪接,我们就能重新寻找剪接酶了。
在那个关键时刻,我做了任何优秀科学家都会做的事:跟随数据的指引。这条线索很快将我引入了当时还属小众的 RNA 科学领域。这位 DNA 研究者不得不转型为 RNA 研究者。尽管当时我并未意识到,但这次转向最终成为我一生中最重要的决定。
RNA 小甜甜圈
当我和 Art 继续探索剪接反应时,实验室的新研究生 Paula Grabowski 又有了一个前所未有的发现。我们一直怀疑 RNA 是否能真正自我剪接,而 Paula 现在又为这一谜团增添了一个同样奇怪的结果。这看似违反直觉,但不知何故,两个看似来自外太空的观察结果让我们感到安慰——我们既非无能,也没有疯。
葆拉【Paula Grabowski】本没打算做出新发现,但发现却找上了她。她决定在 39°C 而非我们标准的 30°C 下进行 RNA 剪接反应,这两个温度都在四膜虫的生长范围内。结果,她看到的不是一个被剪出的内含子产物,而是两个。而且这个新的内含子种类有些古怪。通过凝胶电泳分析时,新内含子移动得非常缓慢。这种 RNA 似乎具有一种不寻常的形状,减缓了它在凝胶中的迁移速度。
尽管环状 RNA 很罕见,且被认为仅存在于病毒和类病毒传染性 RNA 中,但这个内含子在电泳中的行为无疑暗示着它可能是环状或分支结构。宝拉已经提出了几条证据线,表明这个新的内含子种类确实是一个环。但在我们通过电子显微镜一窥这种 RNA 的真容之前,我们无法完全确定。由于我是实验室里唯一的电子显微镜专家,这个任务就落在了我肩上。
那时,我建立实验室并聘请阿尔特已有两年。当时我全职任教,因此大部分实验工作只能在夜间进行。我将葆拉的 RNA 样本固定在网格上——那些直径约八分之一英寸的铜质十字格栅圆盘上,并预约了当晚使用校园里的一台电子显微镜。当我在暗室中调高电压旋钮时,荧光屏发出的万圣节般幽绿光芒映亮了我的脸庞。透过双目镜观察,我激动地看到布满网格的小圆环——那些微小的 RNA 环状结构。眼见为实!诚然,当时环状内含子 RNA 更像是个新奇发现而非重大突破。要理解其意义,我们还需更多研究工作。
那年夏天,我受邀在新罕布什尔州举行的一场关于核酸的 prestigious 会议上就我们最新的 RNA 研究成果发表演讲,这对一位助理教授来说是难得的机会。旅行期间,我总是会打电话回实验室,试图帮助研究继续推进。抵达后的第二天,我与葆拉通话时,注意到她声音里暗藏的兴奋。葆拉分离出了四膜虫内含子被剪接出较大 RNA 后的线性形态,并发现它在试管中静置时,会开始自我转化为环状形态。在 RNA 研究史上,要使 RNA 形成环状结构,总是需要添加蛋白质酶来连接核酸的两端——环化过程从未自发发生过。
尽管我努力想分享她的兴奋,但内心却充满怀疑——甚至有些恼火。为什么一个经验不足的研究生要在我要向这群德高望重的科学家演讲前,用这种完全不可能、明显是荒谬错误的事情来打扰我?我绝不可能在第二天的演讲中提及这些离奇的新结果。
然而回到博尔德后,我发现葆拉那个看似不可能的实验结果竟然是真的,而且完全可重复。于是,我的年轻实验室接连发现了两个颠覆教科书认知的离奇现象:RNA 似乎在没有任何潜在酶源的情况下自我剪接,而被切除的内含子又自行环化——同样没有明显酶参与的迹象。这究竟是怎么回事?
到 1981 年底,我们已将 RNA 剪接与环化反应解析到单个磷氧原子的层面。但关于催化源的问题,我们与 1917 年詹姆斯·萨姆纳之前的酶学家们处境完全相同。我们清楚反应过程,却对其驱动机制困惑不已。RNA 不可能自发完成精准切割与连接——除非等待数千年,即便如此也绝不可能达到我们观察到的原子级精确度。必然存在某种催化剂。
后来事实证明,答案一直就在我们眼前。
采菊东篱下
在那年的化学系圣诞派对上,葆拉送给我一份手工制作的小礼物。那是一朵塑料雏菊,她在交替的花瓣上精心印着“它是蛋白质”和“它不是”。这就是我们的难题。
我们用于实验的 RNA 经过了严格的纯化步骤以去除蛋白质。去除 RNA 中蛋白质的常用技术与我们去除衣物顽固污渍的方法并无太大不同。我们用热水洗涤,因为高温能解开并灭活蛋白质链;使用洗涤剂,同样能解开蛋白质链;甚至可能用“含酶洗衣液”处理衣物,因为已知某些蛋白质酶能分解它们遇到的其他蛋白质。我们的 RNA 经历了所有这些处理——它却依然持续进行剪接并自我环化。这些证据根本不支持我们的样本中存在污染蛋白质的假设。然而我知道,如果我们宣称不存在蛋白质——即 RNA 自身就能完成所有这些复杂反应——某些持怀疑态度的科学家必定会指出,他或她曾听说过某种蛋白质能经受住我们纯化方案中的所有严苛处理。
我们需要的是在不使用四膜虫的情况下生产含有内含子的未剪接 RNA,这样我们就可以安全地排除四膜虫酶的污染。如果人工合成的 RNA 仍然能够进行剪接,并且剪接位点与活细胞中已知的剪接位点相同,那么我们就可以宣称 RNA 是其自身的催化剂。如果这一结论成立,它不仅将彻底改变我们对酶组成成分的理解,还将重新定义 RNA 的功能潜力。
那时基因工程技术尚处于早期阶段,我的实验室和许多其他实验室一样还未掌握这项技术。我们需要使用的流程与当今生物技术公司研发新药时改造基因的方法相同——必须诱导大肠杆菌生产四膜虫核糖体 RNA 基因。这需要将四膜虫 DNA 插入质粒(一种能在细菌细胞内复制的环状 DNA)中。通过这种方式,我们本质上把培养皿里的大肠杆菌变成了基因复印机,源源不断地产出研究工作所需的目标基因。
这种实验如今在我的实验室里由本科生一天就能完成,但在 1982 年,我们摸索了数月才完善流程。当我们终于获得从未接触过活体四膜虫细胞的纯净基因后,仍需要一种名为 RNA 聚合酶的蛋白质将遗传物质复制成 RNA。幸运的是,我妻子卡罗尔是大肠杆菌 RNA 聚合酶纯化专家,她提供了这最后的成分。(与同为生物化学家的伴侣结婚有时确实便利,不过我确信即便她不是我妻子,也会慷慨分我一滴这宝贝。)
在阿尔特·佐格将人工基因复制到 RNA 中后,他接下来使用经过精心优化的步骤去除了我们实验中加入的蛋白质——大肠杆菌 RNA 聚合酶。然后,他将纯化后的 RNA 进行剪接反应,将所有必要的成分以不同浓度加入小塑料管中。这又有点像烹饪。烤蛋糕时,你需要按照食谱准备面粉、糖、鸡蛋、泡打粉和水。而在我们的实验中,食谱要求的是 RNA、一些所有细胞共有的盐类以及鸟苷——RNA 的四种基本组成单元之一,即 RNA 字母表中的 G 核苷酸。和之前一样,RNA 反应的产物通过凝胶电泳分离,并在 X 光胶片上显影。
我的朋友扬·恩伯格【Jan Engberg】是哥本哈根的一位教授,几年前曾帮助我接触四膜虫。当我们进行这项实验时,他碰巧来博尔德拜访我们。实验测试的是人工合成的细菌版本四膜虫 RNA 是否仍能施展其魔力。我至今仍记得扬看到新冲洗出来的胶片时的反应。内含子自行从较大的 RNA 中剪接出来,在凝胶上形成了一条清晰的 400 碱基产物。这一次我们确信没有蛋白质酶的参与。扬的声音变得哽咽,他抬起头,用他那美妙的丹麦口音说道:“你做到了。”
现在是时候来点乐趣了。我们该给这种非凡的 RNA 起什么名字呢?我在实验室的黑板上专门划出一块区域用于命名征集,一周过去,越来越多的提议出现了。其中少不了"sex RNA"(自剪切 RNA 的戏称),还有"Circulon"(能自我环化的新超级英雄)。另有人提议"ARNzyme"——用 RNA 的法语缩写 ARN(Acide ribonucléique)构成合成词,比 RNAzyme 更朗朗上口。但有个命名脱颖而出:ribozyme(核酶),即具有酶活性的核糖核酸。这种 RNA 不仅能自我剪接,还能将自己连接成环状,这让我们确信它确实像酶一样工作——即使在完成剪接反应后,它仍有持续催化的强大能力。
当然,采用如此包罗万象的术语是很大胆的。我们仅有一个例子,却选择了一个适用于整类分子的名称。但我认为风险很小。如果再也找不到第二个例子,我们的发现将只是一个古怪的特例,起什么名字也就无关紧要了。但假如四膜虫为世界提供的是第一例活性 RNA 大分子类别呢?
没过多久,这个问题就得到了肯定的回答。在我们 1982 年 12 月发表关于自剪接 RNA 的论文后几个月内,我陆续收到来自圣路易斯、阿姆斯特丹和奥尔巴尼同行的消息,他们在真菌、面包酵母甚至一种细菌病毒中发现了内含子核酶——后者打破了"RNA 剪接仅存在于真核生物中"的规则。一旦科学家们知道自驱动 RNA 可以存在,他们就开始在自然界各处发现它们。
自剪接 RNA 似乎粉碎了生物学的一项基本信条——所有酶都是蛋白质。并非萨姆纳的观点完全错误,事实上大多数酶确实是蛋白质。然而,这些自剪接 RNA 引发了人们的猜想:在蛋白质尚未出现的远古时代,可能曾有一个由核酶主导催化的时期。
这些发现还引发了另一种推测——自然界中是否还存在尚未被发现的 RNA 催化剂,能够执行各种令人惊叹的反应,而这些反应曾被认为是蛋白质的专属领域。事实证明,一种截然不同的 RNA 催化剂即将在转角处被发现。
一粒盐
与从宙斯头颅中全副武装、完全成形的女神雅典娜不同,RNA 分子并非以最终活性形态直接从 DNA 转录而来。相反,它们在投入工作前会经历加工过程。剪接——即内含子被切除,剩余的 RNA 序列被缝合在一起——只是 RNA 加工中一种公认引人注目的类型。其他 RNA 加工事件则发生在新生 RNA 的末端或附近,包括切除不需要的序列,以及添加 DNA 未编码的碱基。
转运 RNA(tRNA)是一种适配器分子,其一端识别 mRNA 密码子,另一端携带相应的氨基酸,是一个很好的例子。它最初被转录时,适配器前端会带有额外的 RNA 序列,这段附加物必须被精确地在特定碱基处切除,tRNA 才能发挥功能。切割 RNA 的酶被称为核糖核酸酶(ribonuclease),缩写为 RNAase 或 RNase,而专门负责切除 tRNA 前体多余序列的特定酶则被称为核糖核酸酶 P(RNase P)。这里的 P 代表加工(processing)。RNase P 由悉尼·奥尔特曼(Sidney Altman)在英格兰剑桥做博士后期间于大肠杆菌中发现,该实验室也曾培养出弗朗西斯·克里克(Francis Crick)和悉尼·布伦纳(Sydney Brenner)等杰出科学家。
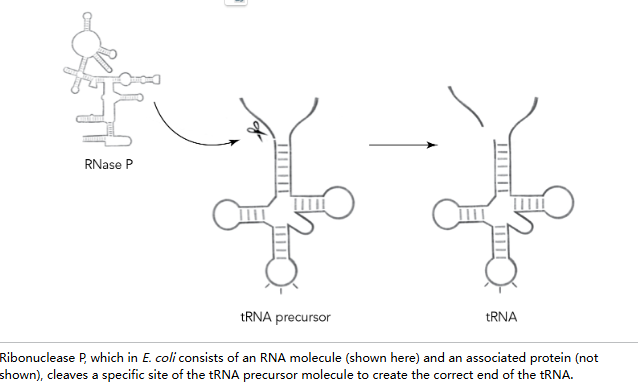
后来,在耶鲁大学自己的实验室里,西德尼·奥尔特曼继续研究 RNase P。这是一种奇特的酶。每当使用几十年来开发的蛋白质纯化技术从大肠杆菌中纯化它时,总会有一个顽固的 RNA 分子伴随而来。西德尼的研究生本·斯塔克为了完成他的博士论文,承受着纯化 RNase P 的压力,并因无法从酶制剂中去除 RNA 而遭受了很多嘲笑。毕竟,所有的酶都是蛋白质,一个合格的研究生理应能够将 RNase P 酶纯化到不含 RNA 的状态。但斯塔克足够坚强和熟练,拒绝接受自己无能的说法,最终他做了一些实验,说服了西德尼和他的论文委员会,RNA 成分确实是 RNase P 酶活性所必需的。当他们分别纯化了 RNA 和蛋白质成分后,需要将它们重新混合才能恢复 tRNA 切割活性。 然而,他们并不认为自己是在重写,而更像是在调整关于酶的黄金法则:他们仍然认为是系统中的蛋白质成分,而非 RNA,在促使反应发生。
那么,为什么 RNase P 需要蛋白质和 RNA 呢?解开这个谜团需要一点机缘巧合。阿尔特曼实验室正在与科罗拉多州的诺姆·佩斯实验室合作进行一系列混合配对实验。西德拥有来自大肠杆菌的纯化 RNase P 蛋白质和 RNA,而诺姆则拥有来自远缘细菌枯草芽孢杆菌的这两种组分。他们好奇跨物种组合(例如大肠杆菌 RNA 加上枯草芽孢杆菌蛋白质)是否具有酶活性。1983 年 9 月 23 日星期五,西德实验室的一位研究员塞西莉亚·古列里-塔卡达进行了这项关键实验。作为一名优秀的科学家,她像阿尔特在我实验室所做的那样,在混合配对实验的同时进行了几项对照实验。最重要的是,她重新测试了仅含 RNA 和仅含蛋白质的反应,这些反应之前都是阴性的。她确信它们再次不会显示出活性。
但这次情况有所不同。诺姆通过电话向西德建议,在一系列反应中添加额外的氯化镁(一种存在于所有活细胞中的常见盐类)可能会有所帮助。这就像许多厨师看到食谱时的做法:他们会稍作调整,测试多加几个鸡蛋或少放点糖是否能让蛋糕更美味。因此,塞西莉亚在将 tRNA 前体与各种 RNase P RNA 及蛋白质组分混合时,将这些新条件与她的标准条件一并纳入。随后,她使用凝胶电泳将 tRNA 前体与反应产物分离,放上 X 光胶片,并让它曝光一整夜。
周六冲洗胶片时,她发现 tRNA 前体像往常一样,被两种 RNase P 酶(大肠杆菌版本和枯草芽孢杆菌版本)在正确位点进行了修剪。类似的结果她已经见过几十次。然而,奇迹出现了!仅含 RNase P RNA(不含其蛋白质搭档)的试管溶液,在加入大量镁盐后,竟也精准修剪了 tRNA 前体。RNA 自身似乎表现出酶活性,而仅含蛋白质的样本则毫无反应。
塞西莉亚立刻意识到她的结果具有开创性意义,因此在告诉任何人之前,她想要确保它是正确的。就在那个星期六,她重复了实验,以确保自己没有搞混试管之类的问题。星期天,她冲洗了 X 光胶片,果然,在高盐条件下,大肠杆菌和枯草杆菌的 RNA 亚基再次表现出酶活性,而蛋白质组分在没有 RNA 的情况下则没有活性。这下“所有的酶都是蛋白质!”的说法可站不住脚了。西德星期天在办公室,所以塞西莉亚能够向他展示这些惊人的结果,并分享他对这一发现的喜悦。
当周一早晨他走进实验室时,西德已经写好了一份宣布这一发现的科学论文初稿。他们打电话给诺姆的实验室,与共同作者们分享这一发现。诺姆同样感到惊讶;“所有酶都是蛋白质”这一公理曾在他的世界观中根深蒂固。
在我们报告自我剪接 RNA 一年后,RNase P 是一种核酶的发现,将核酶的概念扩展到了一个重要的维度。在我们的实验中,我们发现了一种可以自我剪接的 RNA——它可以作为自身的内部催化剂。现在,西德的团队发现 RNA 也可以作为外部催化剂,作用于其他物质——tRNA 前体。在这两种情况下,RNA 都不仅仅是从 DNA 到蛋白质的信息载体,而是细胞反应的主动驱动者。这就是为什么短短六年后,西德和我互补性的发现被授予 1989 年诺贝尔化学奖。
酝酿更多催化性 RNA
科学以神秘的方式运作。你提出一个假设,收集证据,进行实验,核对数据。如果足够幸运,你会做出被同行视为对该领域有重要贡献的发现。但你无法预测接下来会发生什么,谁会接过接力棒,以及他们将把它带向何方。就核酶而言,RNA 催化剂随后在澳大利亚出现,隐藏在名为鳄梨日斑类病毒等植物感染因子中。这些"锤头状"核酶催化了一个非常简单的反应——不是敲钉子,而是在特定位置切割自身或其他 RNA 分子。它们因体积微小(约 30 个核苷酸)而备受关注。这说明并不需要巨大的 RNA 分子就能发挥酶的作用。
科学家们很快发现,RNA 的催化能力也隐藏在参与 mRNA 剪接的 snRNA 中。事实证明,大自然对 snRNA 的依赖远不止于简单地标记剪接位点(尽管这一点至关重要)。除此之外,一组 snRNA 协同作用,催化 mRNA 剪接所需的切割与连接反应。许多研究不同生物系统的科学家为揭示 snRNA 的这些功能做出了贡献,其中包括加州大学旧金山分校的 Christine Guthrie。
克里斯汀采用的实验系统起初在众多 RNA 科学家看来或许并不起眼——就是我们用来酿造啤酒的酵母。但酵母拥有令人惊叹的遗传可塑性——即通过基因突变观察表型变化异常便捷——这使她在 1980 年坚信,酵母能为揭示剪接的基础机制提供突破口。她常赞叹"酵母遗传学的惊人力量"。如果能找到与哺乳动物 U1、U2、U4、U5 和 U6 snRNAs(当时已被认为对 mRNA 剪接至关重要)相对应的酵母 snRNAs,她就能通过序列微调来验证这些分子是与 mRNA 配对还是与其他 snRNAs 相互作用。若实验成功,她将破解 mRNA 剪接中切割与连接反应的核心机制。
幸运的是,克里斯汀对研究有着如此强烈的热情,因为她经常得到的鼓励微乎其微。她的研究生导师曾告诉她:“女孩做不了生物化学。她们举不起沉重的转子(离心机中固定试管的部件),也无法长时间待在冷室(用于生物化学提纯的步入式冰箱)里。”当她为鉴定酵母 snRNA 苦苦挣扎多年时——毕竟,在鉴定出基因之前,你无法对其进行突变——RNA 研究领域的许多人都对此嗤之以鼻。他们一再指出,由于酵母基因中很少有内含子,酵母 mRNA 的剪接机制可能是独特的,与人类无关。回想起来,一些靠进化论吃饭的生物学家竟然怀疑剪接的基本特征在含有内含子的物种间具有保守性,这显得非常奇怪。但寻找酵母 snRNA 的困难助长了他们的怀疑。酵母会不会根本没有 snRNA 呢?
克里斯汀和她的实验室花了五年漫长的时间在酵母细胞中搜寻,最终发现了他们的第一个 snRNA,名为 U5。利用酵母遗传学家所熟知的各种技巧,他们证明了缺乏这种 RNA 的细胞会停止生长并积累未剪接的 RNA——这表明酵母 U5 必定参与了剪接过程。其他研究团队也加入了搜寻行列,很快发现了更多负责剪接反应不同步骤的 snRNA。
克里斯汀现在已经识别出了剪接机制的不同组成部分,但她发现它们能以不止一种方式组合在一起,并且它们的位置在反应过程中会发生变化。这不是一个能在一夜之间解决的问题。
到了 1986 年,研究取得了一些进展。研究人员证实,正如勒纳和斯泰茨最初提出的那样,U1 与每个内含子的左端结合,但后来它离开了现场。克里斯汀实验室的学生罗伊·帕克证明,U2 与每个内含子的右端附近结合。然而,之后发生的事情仍然是个谜。
大约那时,我是一群 RNA 科学家中的一员,我们聚集在落基山脉进行一年一度的滑雪烹饪冒险活动,汤姆·施泰茨称之为“RiboSki”。在雪地里度过一天后,克里斯汀、琼·施泰茨和约翰·阿贝尔森会花上几个小时比较 RNA 剪接数据,而威斯康星大学的埃尔塞贝特·伦德和吉姆·达尔伯格、来自博尔德的奥尔克·乌伦贝克以及我则在旁观。我们都想知道 snRNA 在 mRNA 剪接反应的不同阶段是如何相互靠近的。我确信这种欢乐的氛围催生了许多好点子,但克里斯汀还需要数年的不懈研究才能绘制出剪接反应的每一步。
1992 年的一个夜晚,突破性进展出现了。她在旧金山的实验室工作到很晚,思考着她与学生希滕·马德哈尼(Hiten Madhani)关于名为 U6 的 snRNA 所获得的新结果。这最终成为了关键。当她勾勒出剪接机制的解决方案时,它看起来不像是一个生化反应,而更像是一场精心编排的芭蕾舞。U6 与 U4 紧密缠绕着登场,它们一起在内含子上找到了自己的位置。但随后 U2 插了进来,抢走了 U6,U4 则愤然离场。现在,在 U5 的一些帮助下,U6 和 U2 可以自由地进行完成剪接反应所需的化学反应。它们共同充当核酶,催化 mRNA 的剪接过程。
克里斯蒂娜被她所发现的成果震撼得必须找人分享,但大楼里几乎一片漆黑。她走进走廊,遇到一位正在打扫的看门人,便将自己的新见解告诉了他。
“而他居然听懂了!”
为何这么多科学家——起初甚至包括我、西德·奥尔特曼和诺姆·佩斯实验室里的人——都对 RNA 可能是酶的想法嗤之以鼻?为何我们如此固执地认为催化作用的核心必定是蛋白质?部分原因在于,我们深知蛋白质酶会折叠成精密的形状,专为执行其任务而定制。一旦通过煮沸或基因突变破坏这种结构,活性就会丧失。
相比之下,当时我们对 RNA 结构的了解还不够深入,无法理解 RNA 如何能自我折叠成催化剂。尤其是信使 RNA,常被描绘成像煮熟的意大利面一样,高度灵活且不形成任何稳定形状。即便面条在盘子里盘绕扭曲,一旦你用叉子挑起,它就会立刻伸直。
对于 RNA,科学家们曾在一维或二维的层面思考。我们想象着 A、G、C 和 U 的线性排列,就像这句话中的字母一样顺序排列,以及序列内部的碱基配对,就像上面展示的 U1 snRNA 结构那样。但要理解 RNA 如何能够成为一种酶,就必须从三维的角度来看待它。回想一下,在我们看到 DNA 的三维结构——双螺旋之前,我们对遗传的分子机制知之甚少。同样,除非我们解析出各种催化性 RNA 的结构,否则我们无法期望理解它们。
#:想象一下,四膜虫基因就像一根一英尺长的干意大利面。你可以轻松地拿着它走在街上而不会折断。按同样的比例,一条典型的人类染色体将有 1000 英尺长,相当于三个足球场的长度。如果你有一根那么长的干意大利面,你甚至无法拿起它而不让它断成好几截。