Chapter 5. 母舰(The Mothership)
哈里·诺勒【Harry Noller】与大多数生物化学家不同。很少有人会把“酷”和“生物化学家”这两个词放在同一个句子里,但哈里确实很酷。作为加州大学圣克鲁兹分校的教授,他还是一名爵士乐音乐家,曾与切特·贝克【Chet Baker】一起演奏萨克斯。闲暇时,他喜欢翻新复古法拉利。他还是个天生的语言学家。我曾和哈里一起参加过海外会议,无论我们在世界哪个角落,当我们坐在咖啡馆里时,他似乎都能用当地语言点餐。
加州大学圣克鲁兹分校坐落在蒙特雷湾北缘高耸的红杉林中,环境令人叹为观止。1968 年哈里在此建立研究实验室时,他的目标是理解核糖体的工作机制。这个强大的分子机器负责制造所有生物体内的所有蛋白质,堪称自然界的真正奇迹。就像铁轨上的火车头,核糖体沿着信使 RNA 行进,在每个三联体密码子处短暂停留,等待正确的转运 RNA 与之配对,然后将正确的氨基酸添加到不断增长的蛋白质链上。其功能令人印象深刻地多样化:给它一千种不同的 mRNA,它就能生产出对应的一千种蛋白质。
当哈里开始研究时,人们仍普遍认为蛋白质是自然界中唯一能催化生物反应的物质,因此哈里将使命定为找出核糖体中哪些蛋白质承担了蛋白质合成的艰巨工作。假设性地,可能有一个核糖体蛋白负责结合 mRNA,一两个蛋白负责结合 tRNA,还有一个蛋白可能催化科学家所称的肽基转移——即将两个氨基酸连接在一起的化学反应。
暂且不论核糖体仅由三分之一质量的蛋白质构成,其余三分之二则由核糖体 RNA 组成。科学家们认为这些 RNA——在细菌核糖体中有三种,包括哈里研究的大肠杆菌核糖体——必定提供了某种支架作用,帮助关键蛋白质自我组织。换言之,蛋白质是王者,而核糖体 RNA 不过是侍奉君王的愚钝农夫。
然而,“寻找关键蛋白质”的计划进展并不顺利。哈里建立了一个系统,可以从 RNA 和蛋白质这些基本组成部分重新组装核糖体,然后观察这些重构的核糖体是否具有蛋白质合成的活性。这使他能够每次遗漏一种蛋白质,从而确定哪些是必不可少的——有点像烤面包时每次遗漏一种原料,看看哪些成分不可或缺。在核糖体的实验中,哈里每次遗漏一种蛋白质,结果几乎毫无影响——核糖体依然正常工作。这令人失望,也相当令人困惑。那些关键的催化蛋白质究竟在哪里?
1972 年,哈里实验室的本科生乔纳森·查尔斯需要完成他的毕业论文,于是哈里建议他们尝试一种全新的方法。哈里知道一种名为酮醛的化学物质能特异性地与 RNA 中的 G 碱基反应,使其比正常情况下多出几个原子,却不会影响邻近的蛋白质。此前哈里一直在折腾核糖体的蛋白质却毫无进展。或许关键在于不去动蛋白质,而是摆弄 RNA?
他们采用的蛋白质合成测试与马歇尔·尼伦伯格破译遗传密码时所用的方法相同:取大肠杆菌核糖体(经酮醛处理或未经处理),加入聚尿苷酸作为合成 mRNA,然后观察多聚苯丙氨酸链的生成情况。哈里和乔纳森首次用酮醛处理核糖体时,发现它彻底阻断了蛋白质合成。更关键的是,每个核糖体 RNA 中数百个 G 碱基只有 10 个与酮醛发生了反应,而这已足以使蛋白质合成脱轨。核糖体确实非常介意自己的 RNA 被动手脚。
基于这项实验,似乎是核糖体 RNA 而非任何一种核糖体蛋白承担了结合 tRNA 的关键工作。哈里感觉就像他的法拉利刚刚从加州 1 号公路冲进了太平洋。接下来该何去何从?
航向修正
为了解开核糖体的奥秘,哈里必须转型成为 RNA 专家。这是科学界反复上演的桥段——当科学家正竭力证明某个假设时,数据突然暗示真相可能指向完全不同的方向。这与十年后我实验室的经历极为相似:我们当时执着追寻 RNA 剪接反应中必然存在的某种隐秘蛋白质酶,最终却发现是 RNA 在自我剪接。站在这样的十字路口选择道路从来不是件清晰明了的事,许多科学家因长期深耕特定领域而不愿跨出飞跃的一步。正如常被归功于温斯顿·丘吉尔的那句名言所言:"人们偶尔会绊倒在真理上,但大多数人会爬起来继续赶路,仿佛什么都没发生过。"
不是哈里·诺勒。他明白要理解核糖体 RNA 的功能,就必须先弄清其结构。但在 1972 年,RNA 结构基本还是个谜团,只有 tRNA 的三叶草结构是个例外。哈里清楚 RNA 分子越大,其结构就越难解析——这对他而言是个坏消息,因为所有物种中三种核糖体 RNA 里有两种都大得惊人:大肠杆菌中一种有 1,542 个核苷酸,另一种更是达到 2,904 个核苷酸。第三种较小,仅 120 个核苷酸,但仍比 tRNA 大。
1975 年,哈利正在休假,突然灵光一现。由于有更多时间泡在图书馆,他偶然读到了伊利诺伊大学微生物学家卡尔·沃斯最近发表的一篇论文。几年后,卡尔将发现一个全新的生命领域——古菌,这些生物栖息在黄石国家公园的硫磺温泉以及其他看似不适宜生存的环境中。但在 1975 年,卡尔和他的研究助理乔治·福克斯已经确定了由 120 个核苷酸组成的最小核糖体 RNA 的二维结构。他们的方法基于与 20 世纪 60 年代 tRNA 三叶草结构相同的原理。他们拥有来自十几种不同生物(主要是细菌和一种青蛙)的这种小核糖体 RNA 的序列。形式服从功能,因此他们假设,尽管这些 RNA 在物种间存在序列差异,但它们都会以相同的方式折叠,因为这些 RNA 在核糖体中可能都发挥着相同的作用。在遵循 A-U 和 G-C 碱基配对规则的众多 RNA 结构折叠方式中,只有一种形状适用于所有这十几种生物。 哈利的脑海中灵光一闪:这将通向大型核糖体 RNA 结构的道路,尽管前路崎岖且需耗时数年。
1975 年,当哈里给卡尔·沃斯【Carl Woese】打电话时,两人发现彼此志同道合。他们是那百分之一的异类。当时 99%的科学家仍认为核糖体中起关键作用的必定是蛋白质,它们利用 mRNA 来制造新蛋白质。而另外 1%认为核糖体 RNA 才是关键角色的科学家,就只有哈里和卡尔。“没人把我们当回事,”哈里说,“但好处是我们有整整十年毫无竞争。”
由于加利福尼亚州的圣克鲁兹和伊利诺伊州的厄巴纳相距甚远,合作主要通过电话和邮件进行,交换的是核糖体 RNA 短片段序列的列表。这些短片段是通过用一种叫做核糖核酸酶 T1 的酶切割 RNA 得到的,这种酶会在 RNA 字母表中的每一个 G 之后进行切割。这个过程就像把一页文件放进碎纸机里一样。这是必要的,因为当时只能对短片段 RNA 进行测序。在含有 1,542 个核苷酸的 rRNA 中,有超过 100 个“单词”——即 RNA 核苷酸的短串。沃斯和诺勒的团队弄清了这些单词的拼写(例如 CUCAG 和 UACACACCG)。在拼出组成 rRNA 的所有单词后,他们接下来需要将这些单词组装成一个长句子。这极具挑战性,难度不亚于将碎纸机的输出重新拼回原始文件。直到那时,他们才准备好宣布这 1,542 个核苷酸的 RNA 的完整序列#。 一旦他们掌握了 RNA 序列,就能看出序列的某些部分如何相互配对使 RNA 折叠起来——正如福克斯和沃斯对最小核糖体 RNA 所做的那样,后来弗朗索瓦·米歇尔也将对核酶进行类似的分析。
这份 rRNA 的二维图谱于 1980 年公布,其形态略似芝加哥奥黑尔国际机场的航站楼布局图:众多廊道从中央枢纽向外延伸,部分呈 Y 字形分叉。
一年后,由 2,904 个核苷酸组成的核糖体 RNA 二维结构图也相继问世,呈现出更为庞大的航站楼与廊道系统。
哈里和卡尔称之为“母舰”的这两张地图,为全球数百名核糖体生物学家提供了规划和解释实验结果的框架。但归根结底,仅有地图是不够的。催化作用不会在二维空间发生,若不亲眼目睹母舰的实际运作,就无法真正理解其工作原理。而这一模式反复出现:揭示核糖体的工作机制不仅推动了科学事业的发展,还为抗生素可能挽救生命的改进奠定了基础——这些改进是哈里开始探索核糖体时做梦也想不到的。
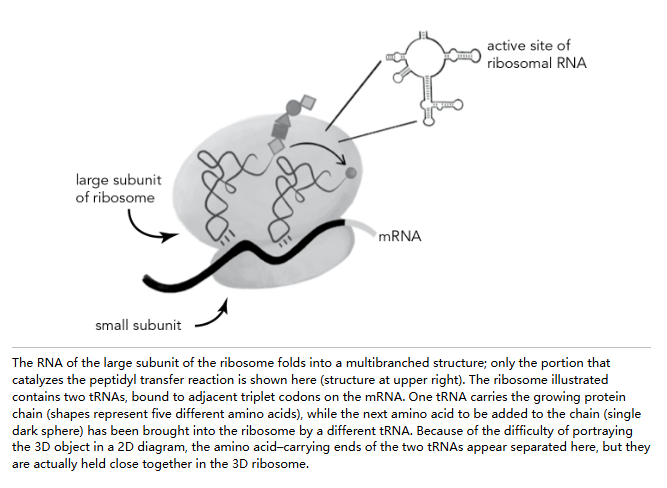
冬眠的蜥蜴与死海
哈里·诺勒可能是几乎唯一坚信核糖体利用 RNA 作为其秘密动力来源的人,但他并非唯一渴望看清其真面目的人。世界各地的生物科学家都渴望一睹这台在每个生物体内合成蛋白质的分子机器的三维结构。然而,要获得清晰的图像,结果却像拍摄尼斯湖水怪一样难以捉摸。
与 tRNA 和核酶一样,当时的技术是 X 射线晶体学。20 世纪 70 年代,Ada Yonath 在以色列雷霍沃特的魏茨曼科学研究所开始为细菌核糖体的结晶奠定基础。她与世界各地许多尝试核糖体结晶的研究人员一样,发现这项工作极其困难,屡遭失败。她本可能放弃,但冬眠熊和意大利南部冬眠蜥蜴体内核糖体自行排列成晶体阵列的报告给了她安慰。她认为,既然核糖体能在寒冷活体动物中形成有序的类晶体阵列,那么在实验室里也应该能让它们结晶。
到 1980 年,约纳特已经能够培养出衍射 X 射线效果相当好的细菌核糖体晶体。但细菌核糖体在高盐溶液(结晶的首选介质)中并不稳定;部分蛋白质会从核糖体上脱落,留下一堆不完整的核糖体颗粒。因此,她和同事们推断,嗜盐生物的核糖体或许能在高盐条件下保持稳定。鉴于他们毗邻死海的地理优势,他们尝试了死海盐杆菌(Halobacterium marismortui),最终发现其核糖体成为了理想的研究对象。
鉴于所有这些进展,破解核糖体的三维结构——包含三个 RNA 分子和 55 种蛋白质——似乎近在咫尺。但实际上,这又花费了 15 年时间。因为正如詹妮弗·杜德纳和我的实验室在努力解析四膜虫核酶结构域时所遇到的情况一样,获得能衍射 X 射线的优质晶体只是成功的一半。另一半则是再次解决“重原子问题”。为了计算 RNA 的三维结构,需要获得 RNA 分子在结合重原子前后清晰的 X 射线衍射数据。这正是汤姆·施泰茨和文卡特拉曼·拉马克里希南登场的地方。
揭开水晶宫的面纱
到目前为止,我们一直以单数形式谈论核糖体。但实际上,核糖体并非单一实体,而是由两个巨大的复合体组成——分别称为大亚基和小亚基——它们由 RNA 和蛋白质构成,共同完成所有物种中蛋白质合成的工作。核糖体的小亚基包含三种 rRNA 中第二大的(1,504 个核苷酸)和 22 种蛋白质。它首先与 mRNA 结合。然后,核糖体的大亚基——由另外两种 rRNA(2,904 和 120 个核苷酸)以及约 33 种蛋白质组成——加入进来。大亚基容纳了催化中心,负责将氨基酸一个接一个地连接起来,生成我们称之为蛋白质的氨基酸链。这些细节很重要,因为接下来我们故事中的两位主角各自研究了一个不同的亚基:Tom Steitz 研究大亚基,Venki Ramakrishnan 研究小亚基。
到 1995 年,汤姆·施泰茨在解析生物学中最基础分子机器的结构方面已创下无与伦比的记录。他确定了 DNA 聚合酶的结构,这种酶能将亲代双螺旋复制成两个子代;他解析了 RNA 聚合酶的结构,该酶负责将 DNA 信息转录为 RNA;他还揭示了 HIV 逆转录酶的结构,该酶将 HIV 的 RNA 逆转录为 DNA 并插入人类染色体中。此外,他还测定了一种将正确氨基酸连接到 tRNA 分子上的酶的结构。
但汤姆能否攻克这个终极难题?1995 年,他组建了一支由三位博士后研究员组成的团队,准备迎接这场冒险。他们与汤姆的老友兼耶鲁同事、核糖体专家彼得·摩尔联手。团队选择死海细菌作为核糖体亚基的来源,因为阿达·约纳特已为此铺平了道路。施泰茨团队聚焦于大亚基——负责催化氨基酸连接形成蛋白质——而要破解其结构,他们必须解决令人望而生畏的重原子问题。
技术娴熟的水手汤姆用一个航海故事来解释这个问题。他将 X 射线晶体学中的重原子测量比作通过从载有船长的船重量中减去空船重量来测量船长体重的难题。如果船是一艘小帆船,这种方法还算可行。但如果是皇家邮轮玛丽皇后号呢?那么从玛丽皇后号加上船长的总重量中减去玛丽皇后号的自重,就成了测定船长体重的极端困难方法。而拥有 25 万个原子的核糖体,正是生物分子机器中的"玛丽皇后号"。
关键性的一刻出现在 Steitz 团队找到了解决“如何称量船长”问题的方法时……他们使用了一位极其“沉重”的船长——由 18 个钨原子组成的团簇,恰好嵌入了核糖体亚基的特定裂隙中。由于钨是传统灯泡内发光灯丝的制造材料,可以说这一妙招点亮了结构。随后的几年里,Steitz 实验室陆续发布了核糖体大亚基越来越清晰的照片,最终在 2000 年获得了一张当时难以想象的高分辨率图像。
解析生物分子机器的三维结构是什么感觉?就像一座长期被巨大帷幕笼罩的水晶宫殿。数百名研究人员通过间接方法拼凑内部的样貌——一定有厨房、餐厅、多间卧室和浴室。但无人知晓这些房间如何彼此相连。整体布局如何?平面设计又如何支撑宫殿的功能?而后在某个瞬间,结构豁然开朗。巨大帷幕被掀开的刹那,你能透过透明墙壁看清内部每个角落,甚至漫步于所有房间。这就是通过 X 射线晶体学解析原子结构的体验。你会突然看清全球科学家多年实验室研究中提出、探索和假设的所有细节,并明辨哪些想法正确,哪些存在谬误。
对 Steitz 团队而言,一个启示性的时刻出现在他们窥见大核糖体亚基的催化中心时,发现它完全由 RNA 构成。周围没有任何蛋白质存在。
Harry Noller 和 Carl Woese 基于他们艰苦的实验和精准的直觉所提出的关于 RNA 核心地位的一切假设都被证实是正确的。核糖体实际上是一种核酶,即催化 RNA 机器。当然,RNA 由一系列蛋白质支撑,就像 RNase P RNA 在细胞环境下由帮助维持 RNA 有序结构的蛋白质支持一样。但核糖体的核心纯粹是 RNA。
但此刻,我们的故事只讲了一半。是的,核糖体大亚基的结构以原子级细节展示了是 RNA 酶(而非蛋白质酶)催化了氨基酸串联成蛋白质的过程。然而,解读 mRNA 中的密码并排列正确的 tRNA(这些适配器决定了哪些氨基酸被串联起来)的关键步骤又如何呢?解码信息的秘密将藏在核糖体的小亚基中。
文基·拉马克里希南【Venki Ramakrishnan】在印度长大,在俄亥俄大学获得物理学博士学位,随后在耶鲁大学做博士后期间迷上了核糖体。1995 年,文基加入犹他大学任教,并将注意力转向解析核糖体小亚基的结构。他与研究生比尔·克莱蒙斯【Bil Clemons】完善了培育核糖体亚基优质晶体的方法,随后直面令人畏惧的重原子问题。他们尝试了所有能获取的重原子浸泡法,与施泰茨实验室对大亚基的研究一样,最终是钨原子团点亮了结构。1999 年,文基转赴英国剑桥久负盛名的分子生物学实验室,不到一年时间,他的团队就完成了始于犹他州的研究工作——成功解析核糖体小亚基结构。他们凝视着自己的晶体宫殿,以惊人的清晰度窥见了其精妙构造。
但小亚基结构中缺少了一些东西。住在宫殿里的家族——mRNA 和 tRNAs——并不在家,原因很简单:它们没有被包含在结晶混合物中。研究核糖体的目的是理解蛋白质合成,而正如我们已经了解到的,核糖体并不能独自制造蛋白质。它需要 mRNA 来指定制造哪种蛋白质,还需要 tRNAs 来携带匹配的氨基酸。因此,仅通过观察核糖体结构来理解蛋白质是如何构建的颇具挑战性。你需要确切地看到 mRNA 和 tRNAs 的适配位置;你需要看到房子及其居住者。
将整个核糖体及其功能家族成员——tRNA 和 mRNA——可视化的挑战落在了杰米·凯特【Jamie Cate】身上,他当时已转至加州大学圣克鲁兹分校哈里·诺勒的实验室进行博士后研究。幸运的是,他在耶鲁大学与詹妮弗·杜德纳共同解析核酶结构时积累了丰富经验,为这项工作做足了准备。1999 年,杰米和哈里成功破解了首个处于功能状态(包含 tRNA 和 mRNA)的核糖体晶体结构。不过他们的晶体对 X 射线的衍射程度有限,因此所得图像略显模糊——他们仿佛透过雾气弥漫的护目镜观察这座晶体宫殿。
但这两个不尽完美的视角——杰米和哈里提供的核糖体全貌及其伙伴略显朦胧的图像,与文基提供的空载小亚基超高分辨率结构——形成了绝妙的互补。将 mRNA 和 tRNA 的位置叠加到高分辨率结构上后,核糖体 RNA 碱基如何协助解读 mRNA 密码的机制便清晰呈现:某些 rRNA 碱基固定着 tRNA,而另一些则负责定位 mRNA 以实现解码。
一切都围绕着 RNA 展开。那些固定 tRNA 和 mRNA 的功能位点几乎完全由 RNA 构成。连接小核糖体亚基与大亚基的关键界面?同样,大部分是 RNA。小亚基的 22 种蛋白质中只有一种参与协助,其余所有活动显然都是由 RNA 主导组织的。
40 年间,科学界从破译 mRNA 密码子发展到以惊人细节观察其如何被解码以实现蛋白质合成。诺勒和沃斯再次得到证实。他们再也无需哀叹自己属于那 1%坚信 RNA 才是蛋白质合成关键、蛋白质仅扮演小配角的少数派了。眼见为实。如今整个科学界不得不承认 RNA 才是主宰。
谁在给谁下药?
蛋白质合成核糖体几乎完全依赖 RNA 运作这一事实,或许会让像哈里和我这样的生物化学家震惊不已,但若您疑惑这为何值得关注,我们也表示理解。理解核糖体 RNA 的结构与功能究竟有何实际意义呢?
以抗生素为例。解开核糖体结构让我们对许多抗生素的作用机制、抗生素耐药性如何产生以及未来如何改进抗生素有了前所未有的深刻理解。
一种有效的抗生素需要破坏细菌的关键过程,同时不影响相关的人类生理活动。你可能会认为核糖体是个糟糕的靶点,因为它的核心结构特征——大亚基、小亚基、结合 tRNA 和 mRNA、催化氨基酸组装——在所有生命形式中都存在。但事实证明,从进化角度而言,在人类与细菌分道扬镳的十亿年间,人类与细菌的核糖体已产生足够差异,使得我们能够找到仅抑制细菌核糖体的药物。值得注意的是,约半数有效抗生素都以细菌核糖体为作用靶点。
20 世纪 60 年代,抗生素刚刚开始在医疗领域广泛应用,引发了人们对其作用机制的浓厚兴趣。与此同时,核糖体、信使 RNA、转运 RNA 和遗传密码相继被发现,这两个领域的研究产生了交汇。科学家们发现,许多常见抗生素——包括治疗肺结核、淋病甚至痤疮的药物——正是通过抑制细菌的蛋白质合成能力来杀灭病菌。研究很快表明,这些抗生素会直接与细菌核糖体结合。
在这里,尺度感很有用。一个典型的抗生素药物分子大约由 100 个原子组成,而细菌核糖体则包含约 25 万个原子。核糖体比药物分子大 2500 倍。就像谚语中扔进机器里的猴子扳手一样,如果药物与核糖体内功能关键位点结合,这个小分子就能使庞大的核糖体失活。若药物仅附着于核糖体表面,则不会造成损害,也绝不可能成为抗生素。正因如此,观察抗生素与细菌核糖体的结合不仅对制药业意义重大,对想理解核糖体运作机制的基礎科学家也同样重要。
理解这一现象的一个早期关键就是抗生素耐药性细菌。无论是过去还是现在,一旦某种抗生素开始被广泛使用,某些幸运的细菌就会恰好发生突变,从而免受抗生素的影响。随着其周围细菌的死亡,这些幸运的细菌会繁殖并占据整个种群。这似乎是不可避免的:一旦出现能有效杀死某种细菌的抗生素,抗生素耐药性就会随之出现。核糖体中的突变如何能赋予细菌抗生素耐药性呢?
再次将核糖体想象成一列沿着信使 RNA 轨道行驶的火车头。每种抗生素都像一把尺寸和形状极为特定的活动扳手。某把扳手可能卡入引擎活塞使其无法移动,而另一把则可能滑入驱动轮令其停止转动。正如上百种抗生素能以不同方式干扰核糖体,上百种扳手也能以不同方式弄坏火车头。现在假设某列火车头与其他火车头存在微妙的设计差异——它的活塞尺寸不同,通向驱动轮的凹槽也略窄。那些能弄坏其他火车头的扳手对这列新火车头毫无作用:它具备了抗性。
由于抗生素耐药性非常普遍,科学家们很容易就能获得各种具有抗生素抗性的核糖体。在每种情况下,他们都会提出一个问题:赋予抗生素抗性的突变在哪里?是在核糖体 RNA 中,还是在众多核糖体蛋白之一中?从 20 世纪 70 年代开始,科学家们对耐药细胞中的核糖体 RNA 和核糖体蛋白进行了测序,并发现了两种情况的实例。在某些情况下,核糖体蛋白中氨基酸序列的变化赋予了抗生素抗性。但在其他情况下,是核糖体 RNA 中碱基序列的变化起到了作用。后一种情况为 RNA 研究领域的 Harry Noller、Carl Woese 及其同事提供了早期的鼓励,支持了核糖体 RNA 对核糖体功能至关重要的这一当时仍处于萌芽阶段的想法。
所有这些证据都略显间接,因此当核糖体 X 射线晶体学在 2000 年左右取得突破时,包括汤姆·施泰茨、文卡特拉曼·拉马克里希南和阿达·约纳特在内的许多研究人员立即抓住机会,想确切看看抗生素药物在核糖体中的结合位置。理想情况下,他们本希望观察那些作为抗生素靶标的致病细菌的核糖体。但这些核糖体尚未被结晶化,于是他们将抗生素添加到近缘细菌的核糖体中,推测其作用机制应相似,并进行了观察。
施泰茨实验室捕捉到了七种不同抗生素药物与大核糖体亚基结合的照片,它们全都结合在其催化中心。每种药物的结合位置略有差异,但所有情况都明显阻碍了 tRNA 末端停靠到核糖体参与蛋白质合成。此外,每种药物都是与核糖体大 RNA 结合,而非蛋白质。毕竟,如果要赢得与核糖体的这场“棋局”,直接吃掉 RNA“国王”可能比消灭蛋白质“小卒”更有效。
红霉素能有效治疗如链球菌性喉炎等细菌感染,被发现可与核糖体大亚基上的特定位点结合。在蛋白质合成过程中,核糖体会将正在构建的蛋白质从“出口通道”挤出。研究发现,红霉素的结合位置恰好阻塞了这一出口通道,从而阻止了正在延伸的蛋白质链继续增长。汤姆·施泰茨喜欢将这种抑制机制称为“分子便秘”。
核糖体小亚基自身也存在抗生素可攻击的弱点。文基的研究团队拍摄到了六种抗生素(包括链霉素和四环素)与小亚基 RNA 结合的照片。每种抗生素都揭示了核糖体工作机制的某些方面。以治疗淋病的壮观霉素为例,核糖体的一个关键功能是转位——即携带结合 tRNA 的 mRNA 密码子在核糖体内从一个位点移动到另一个位点。这一过程需要在每次密码子读取后发生,以便为下一个 tRNA 的进入腾出空间。
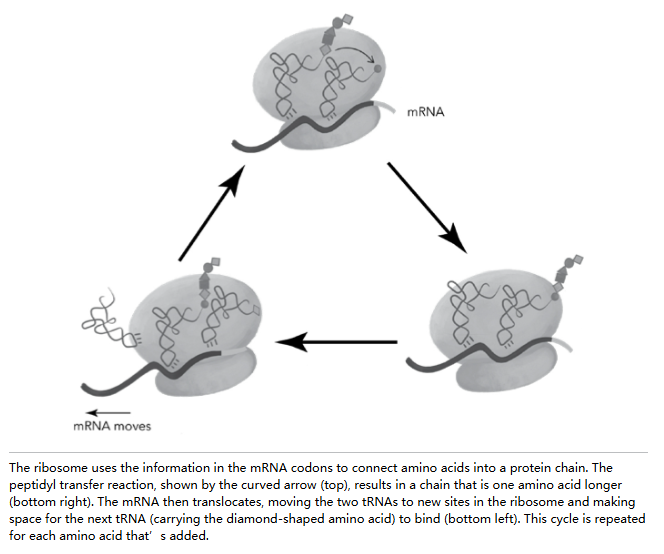
这种移位步骤需要小亚基“头部”的运动。就像点头一样——每次移位点一次头。壮观霉素是一种刚性分子,简直就是一个小扳手,它恰好嵌入核糖体 RNA 中靠近头部枢轴点的特定位置。这阻碍了头部的点头动作,从而阻止了移位。难怪壮观霉素能杀死细菌:如果它们的核糖体无法点头,就无法制造生存所需的任何蛋白质。
各种核糖体结构有望为生物医学界提供一种对抗抗生素耐药细菌的强大新工具。在所谓的基于结构的药物设计中,科学家们会检查致病蛋白质的表面,或者在抗生素的情况下,检查病原细菌中的任何必需蛋白质。当他们发现目标分子功能关键部分存在凹陷时,会使用计算机化的“对接”软件来预测能够填充该凹陷的小型药物分子的形状——就像扳手嵌入机器一样。关键在于,如果没有详细的结构模型,就无法进行基于结构的药物设计,而核糖体结构现在提供了这一模型。
在 20 多年的时间里,RNA 在科学界的形象发生了翻天覆地的变化。20 世纪 60 年代中期,人们认为 RNA 是 DNA 和蛋白质之间的传递者——一种信使。接着是核糖体 RNA,它并不编码任何东西,但在蛋白质合成机制中发挥某些功能——最初被认为是一种支架,用来组织关键蛋白质。还有转运 RNA,人们理解它们是连接 mRNA 密码子和正确氨基酸的重要适配器,但并未被视为 RNA 具有大量非编码功能的先兆。然后到了 20 世纪 80 年代,一系列发现表明 RNA 可以是一种生物催化剂,snRNA 能够协调 mRNA 的剪接,而核糖体 RNA 直接负责生命中最核心的过程之一——蛋白质合成。RNA 已经从伴唱歌手蜕变为舞台中央的明星。
这些全都是颠覆性的进展,它们重写了生物学教科书,并将引领对人类疾病更深入的理解与治疗。但 RNA 研究不仅在当下重塑科学规则,它还将为我们解答一个古老而深邃的问题:地球上的生命是如何开始的?
#:值得注意的是,对这种 RNA 进行测序——在 20 世纪 70 年代需要耗费约 20 人年才能完成——如今通过自动化测序仪仅需一天即可常规实现。这一技术进步使得人类微生物组计划成为可能,因为核糖体 RNA 序列能立即识别出环境样本或人体部位拭子中存在哪些细菌。